ОБЩИЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
Основными элементарными частицами, из которых строятся все вещества, являются протоны, нейтроны и электроны. Протоны имеют положительный заряд, электроны – отрицательный, нейтроны являются нейтральными частицами, не имеющими заряда. Заряды протона и электрона равны по величине и составляют 16·10-20 К.
Согласно упрощенной модели Нильса Бора атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, компенсируя положительный заряд ядра. Ядро состоит из протонов и нейтронов. Электроны располагаются вокруг ядра несколькими слоями – оболочками на очень большом по сравнению со своими размерами расстоянии. Строение ядер атомов и периодичность заполнения оболочек электронами можно находить с помощью таблицы Д.И. Менделеева.
Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Атом имеет размеры около 0,1 нанометра (нм). Молекулы различных веществ содержат различное число атомов. Например, гелий и аргон – одноатомные газы, водород и кислород – двухатомные, озон – трехатомный. В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Наиболее часто встречаются молекулы, в которых существуют ковалентные и ионные химические связи.
Ковалентная связь (рис.1) возникает при обобществлении электронов двумя соседними атомами. Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются неполярными. Если же в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называются полярными или дипольными.
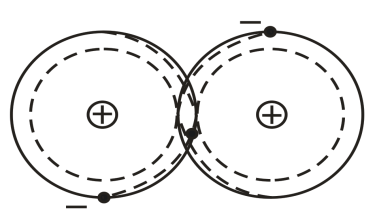
Рис.1. Схематическое изображение двухатомной молекулы с ковалентной связью
Полярная молекула характеризуется величиной дипольного момента (μ), который определяется по формуле:
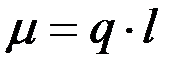 (1)
(1)
где q – заряд, l – расстояние между центрами положительного и отрицательного зарядов.
Электрический момент полярноймолекулы является векторной величиной. За направление векторапринимают направление от отрицательного заряда к положительному. При отсутствии внешнего электрического поля суммарныйдипольный момент равен нулю, так как диполи расположены хаотично. При приложении внешнего электрического поля диполи и их электрические моменты ориентируются по направлению поля.
Второй вид связи – ионная связь – определяется силами притяжения между положительными и отрицательными ионами. Твердые тела ионной структуры характеризуются повышенной механической прочностью и относительно высокой температурой плавления. Вещества ионной структуры могут быть с плотной или неплотной упаковкой ионов (рис.2).
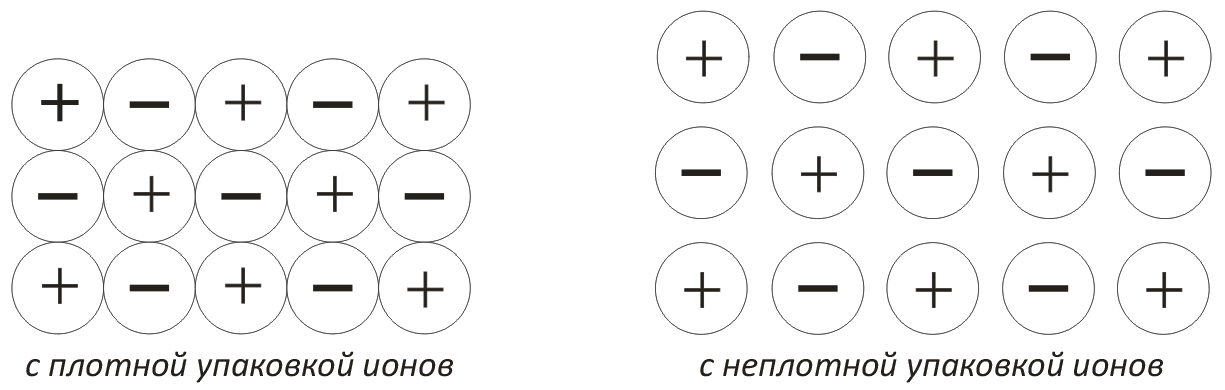
Рис. 2. Ионная структура материалов
Третий вид связи – металлическая связь, которая также приводит к образованию твердых кристаллических тел.
Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов (рис.3).
Притяжение между положительными ионами и электронами является причиной монолитности металлов. Наличием свободных электронов объясняется высокая электропроводность и теплопроводность металлов.
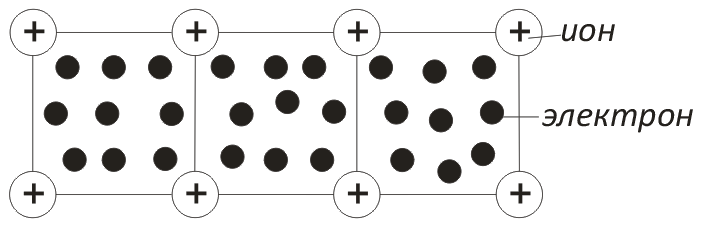
Рис.3. Схематическое изображение металлической связи
Четвертый вид связи – молекулярная связь (связь Ван-дер-Ваальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение в этом случае обусловливается согласованным движением валентных электронов в соседних молекулах (рис.4).
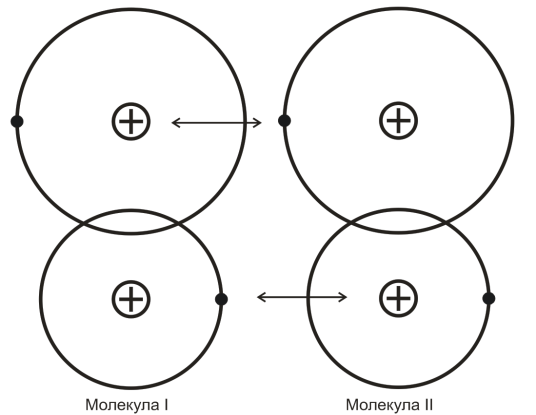
Рис.4. Схематическое изображение молекулярной связи
В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит. Вещества, имеющие данный вид связи, например, парафин, обладают низкой температурой плавления, свидетельствующей о непрочности их кристаллической решетки.
Вернуться к содержаниию
Дата добавления: 2019-09-30; просмотров: 378;










