Растворы электролитов
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Ранее уже отмечалось, что растворы, являясь многокомпо-нентными системами, приобретают некоторые свойства, которыми не обладают отдельные компоненты раствора. Для химии большой интерес представила бы возможность определения свойств растворов по известным характеристикам индивидуальных компонентов. Однако в настоящее время такая задача не решена и общая теория растворов не создана.
В то же время термодинамическая теория растворов позволяет устанавливать взаимосвязь между отдельными характеристиками раствора. Иными словами, можно вычислять одни параметры раствора, если известны другие.
Основными независимыми переменными в теории растворов являются концентрация, температураидавление. В некоторых случаях число переменных, необходимых для расчета остальных параметров раствора, удается свести к минимуму. Так, определенные свойства разбавленного раствора нелетучего неэлектролита можно рассчитать, зная только концентрацию раствора и при этом абстрагируясь от химической природы растворенного вещества.
Свойства растворов, которые зависят только от концентрации компонентов, но не зависят от их природы, называются коллигативными.
К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара над раствором по сравнению с растворителем;
2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с раствори-телем;
3) осмотические явления.
Давление насыщенного пара.
Закон Рауля
Пар, находящийся в динамическом равновесии со своей жидкостью называется насыщенным. Насыщенный пар характери-зуется давлением P (Па, атм), которое иногда называют упругостью пара. Давление насыщенного пара зависит от природы жидкости и от температуры. С ростом температуры давление насыщенного пара возрастает (рис. 1.).

Рис. 1. Зависимость давления насыщенного пара растворителя от температуры.
Добавление в растворитель растворенного вещества (нелетучего неэлектролита) приводит к тому, что на протяжении всего температурного интервала давление насыщенного пара растворителя над раствором (кривая 2) ниже давления насыщенного пара над чистым растворителем (кривая 1). Это связано с уменьшением количества свободных молекул растворителя на поверхности жидкости.
Закон Рауля:
Относительное понижение давления пара растворителя над раствором нелетучего неэлектролита равно мольной доле раство-ренного вещества:
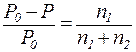 , ,
| (1) |
где Р – давление насыщенного пара растворителя над раствором
(атм; Па; мм. рт. ст.);
Р0 – давление насыщенного пара над чистым растворителем
(атм; Па; мм. рт. ст.);
n1 – количество растворенного вещества (моль);
n2 – количество растворителя (моль).
Температура, при которой давление пара растворителя над раствором становится равным давлению пара над твердой фазой, называетсятемпературой кристаллизации раствора (Tкр.).
Температура, при которой давление пара растворителя над раствором становится равным атмосферному давлению, назы-ваетсятемпературой кипения раствора (Tкип.).
Из рис. 1 видно, что температура кристаллизации раствора (Tкр.) несколько ниже температуры кристаллизации чистого растворителя (T0 кр.). Разность температур кристаллизации растворителя и раствора DTкр.можно рассчитать по одному из следствий из закона Рауля:
Понижение температуры кристаллизации раствора по сравнению с растворителем прямо пропорционально моляльной концентрации раствора:
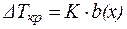 , ,
| (2) |
где К – криоскопическая постоянная растворителя (К×кг/моль);
b(х) – моляльная концентрация раствора (моль/кг).
Другое следствие из закона Рауля позволяет рассчитать повышение температуры кипения раствора по сравнению с растворителем DTкип.:
Повышение температуры кипения раствора по сравнению с растворителем прямо пропорционально моляльной концентрации раствора:
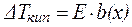 , ,
| (3) |
где Е – эбулиоскопическая постоянная растворителя (К×кг/моль).
Значения констант К и Е определяются исключительно природой растворителя.
Значения криоскопических и эбулиоскопических констант некоторых растворителей приведены в таблице 1.
Таблица 1. Физико-химические характеристики растворителей.
| Растворитель | Температура кипения, 0С | Температура кристал-лизации, 0С | Эбулиоско-пическая константа, К×кг/моль. | Криоско-пическая константа, К×кг/моль. |
| Вода | 0,52 | 1,86 | ||
| Бензол | 80,1 | 5,5 | 2,56 | 5,10 |
| Этанол | 78,4 | -114,15 | 1,16 | 1,99 |
| Ацетон | 56,2 | -95,35 | 1,50 | 2,40 |
| Хлороформ | 61,2 | -63,5 | 4,90 | 3,90 |
| Диэтиловый эфир | 34,5 | -116,2 | 2,02 | 1,79 |
| Камфора | 5,95 | 39,7 |
Следствия из закона Рауля позволяют также решить и обратную задачу: зная величину DTкип. (или DTкр.) можно рассчитать молярную массу растворенного вещества M(x):
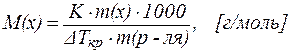
| (4) |
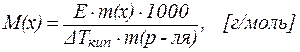
| (5) |
Диффузия и осмос
Процесс самопроизвольного выравнивания концентраций веществ в термодинамической системе называют диффузией.
Диффузия является двусторонним процессом. Так, в растворах в процессе диффузии участвуют как молекулы растворителя, так и молекулы (ионы) растворенных веществ.
Процесс преимущественно одностороннего проникновения молекул растворителя через полупроницаемую мембрану называют осмосом.
В процессе осмоса, молекулы растворителя проникают через полупроницаемую мембрану либо из растворителя в раствор, либо из разбавленного раствора в более концентрированный.
Явление осмоса схематично представлено на рис. 2, из которого видно, что в процессе осмоса уровень жидкости в объеме с раствором глюкозы повышается. При этом создается дополнительное гидро-статическое давление, препятствующее дальнейшему проникновению растворителя через мембрану.
Дополнительное гидростатическое давление, при котором осмос прекращается, называют осмотическим давлением.
Осмотическое давление обозначают буквой p и выражают в кПа или в атм.
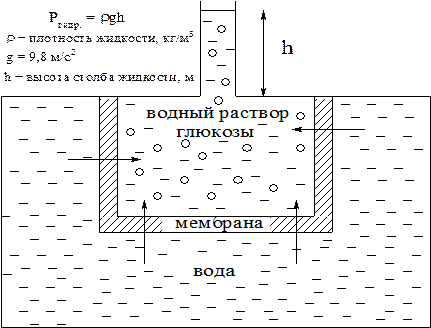
Рис. 2. Явление осмоса.
Изучая осмотические явления, Вант-Гофф установил их полную аналогию с законами поведения идеальных газов.
Закон Вант-Гоффа:
Осмотическое давление разбавленных растворов неэлектро-литов прямо пропорционально молярной концентрации раствора и абсолютной температуре:
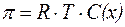
| (6) |
где С(х) - молярная концентрация раствора, моль/л;
R - газовая постоянная (8,31 Дж/(моль×К); 0,082 л×атм/(моль×K));
Т - абсолютная температура (К).
Интересно отметить, что даже при сравнительно небольших кон-центрациях, растворы могут обладать значительным осмотическим давлением. Так, осмотическое давление одномолярного раствора глюкозы при 00С составляет 22,4 атм.
Растворы электролитов
Из рис. 1 видно, что при равных концентрациях растворов дав-ление насыщенного пара растворителя над раствором электролита (кривая 3) ниже, чем над раствором неэлектролита той же концентра-ции (кривая 2). Это объясняется тем, что диссоциацияэлектролита приводит к увеличению общего числа частиц растворенного вещества. Вследствие сольватации образовавшихся ионов умень-шается количество свободных молекул растворителя на поверхности раздела жидкость-пар. Таким образом, свойства, зависящие от общего числа находящихся в растворе частиц растворенного вещества (коллигативные свойства), проявляются в растворах электролитов в большей степени, чем в равных им по концентрации растворах неэлектролитов.
Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете коллигативных свойств:
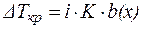 , ,
| (7) |
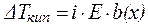
| (8) |
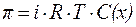
| (9) |
где i – изотоническийкоэффициент (коэффициентВант-Гоффа).
Изотонический коэффициент i связан со степенью диссоциации электролита a следующим соотношением:
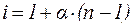 , ,
| (10) |
где n – число ионов, на которые при диссоциации распадается электролит.
Пример 1. Рассчитать изотонический коэффициент Вант-Гоффа для АlСl3, если «кажущаяся» степень диссоциации 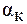 = 80%.
= 80%.
Решение.
В растворе сильного электролита изотонический коэффициент рассчитывается по формуле:
i = 1 + 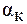 ∙(n – 1).
∙(n – 1).
Степень диссоциации 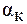 выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
AlCl3 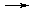 Al3+ + 3Cl-
Al3+ + 3Cl-
Таким образом:
n = 4,
i = 1 + 0,8×(4 – 1) = 3,4.
По опытным величинам p, DTкип. и DTкр. можно определить значение i, что, в свою очередь, позволяет вычислить степень диссоциации электролита в растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким образом значение 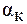 выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие «кажущейся» степени диссоци-ации от единицы связано с межионным взаимодействием в растворе.
выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие «кажущейся» степени диссоци-ации от единицы связано с межионным взаимодействием в растворе.
Дата добавления: 2016-10-18; просмотров: 2799;










