Энтропия. Энергия Гиббса
Одним из важнейших вопросов химии является вопрос о возможности протекания химической реакции. Количественным критерием принципиальной осуществимости химической реакции является, в частности, характеристическая функция состояния системы, называемая энергией Гиббса (G). Прежде чем перейти к рассмотрению этого критерия, остановимся на ряде определений.
Самопроизвольные процессы. Самопроизвольными называют процессы, происходящие без подвода энергии от внешнего источника. Многие химические процессы являются самопроизвольными, например растворение сахара в воде, окисление металлов на воздухе (коррозия) и др.
Обратимые и необратимые процессы. Многие химические реакции протекают в одном направлении до полного исчерпания реагирующих веществ. Такие реакции называются химически необратимыми. В качестве примера можно привести взаимодействие натрия и воды.
Другие реакции протекают вначале в прямом направлении, а затем в прямом и обратном благодаря взаимодействию продуктов реакции. В результате образуется смесь, содержащая одновременно исходные вещества и продукты реакции. Такие реакции называют химически обратимыми.В результате химически обратимого процесса наступает истинное (устойчивое) химическое равновесие, которое характеризуется следующими признаками:
1) в отсутствие внешних воздействий состояние системы остается неизменным неограниченно долго;
2) любое изменение внешних условий приводит к изменению состояния системы;
3) состояние равновесия не зависит от того, с какой стороны оно достигнуто.
В качестве примера системы, находящейся в состоянии истинного равновесия, можно привести эквимолекулярную смесь
СО(г) + Н2О(г)  СО2(г) + Н2 (г).
СО2(г) + Н2 (г).
Любое изменение температуры или других условий вызывает смещение равновесия, т.е. изменение состава системы.
Кроме истинных равновесий очень часто встречаются кажущиеся (ложные, заторможенные) равновесия, когда состояние системы сохраняется во времени очень долго, но небольшое воздействие на систему может привести к сильному изменению ее состояния. Примером может быть смесь водорода и кислорода, которая при комнатной температуре в отсутствие внешних воздействий может оставаться неизменной неограниченно долго. Однако достаточно ввести в эту смесь платинированный асбест (катализатор), как начнется энергичная реакция
Н2(г) + О2(г) = Н2О(ж),
ведущая к полному исчерпанию исходных веществ.
Если ввести тот же катализатор при тех же условиях в жидкую воду, то получить исходную смесь невозможно.
Энтропия. Состояние любой системы может быть охарактеризовано значениями непосредственно измеряемых параметров (р, Т и др.). Это характеристика макросостояния системы. Состояние системы может быть описано также характеристиками каждой частицы системы (атома, молекулы): координатой, частотой колебания, частотой вращения и т.д. Это характеристика микросостояния системы. Системы состоят из очень большого числа частиц, поэтому одному макросостоянию будет отвечать огромное число различных микросостояний. Это число называется термодинамической вероятностью состояния и обозначается как W.
Термодинамическая вероятность связана с другим свойством вещества – энтропией (S, Дж/(моль.К)) –формулой Больцмана
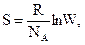 (3.13)
(3.13)
где R − универсальная газовая постоянная, а NA – постоянная Авогадро.
Физический смысл энтропии может быть пояснен следующим мысленным экспериментом. Пусть идеальный кристалл какого-либо вещества, например хлорида натрия, охлажден до абсолютного нуля температуры. В этих условиях ионы натрия и хлора, составляющие кристалл, становятся практически неподвижными, и данное макроскопическое состояние характеризуется одним единственным микросостоянием, т.е. W=1, и в соответствии с (3.13) S=0. При повышении температуры ионы начнут колебаться около положений равновесия в кристаллической решетке, число микросостояний, соответствующих одному макросостоянию, возрастает, и, следовательно, S>0.
Таким образом, энтропия является мерой неупорядоченности состояния системы. Энтропия системы увеличивается во всех процессах, сопровождающихся уменьшением упорядоченности (нагревание, растворение, испарение, реакции разложения и т.п.). Процессы, идущие с увеличением упорядоченности (охлаждение, кристаллизация, сжатие и т.п.), приводят к уменьшению энтропии.
Энтропия является функцией состояния, но в отличие от большинства других термодинамических функций возможно экспериментальное определение абсолютного значения энтропии вещества. Эта возможность основана на постулате М. Планка, согласно которому при абсолютном нуле энтропия идеального кристалла равна нулю(третий закон термодинамики).
Температурная зависимость энтропии вещества представлена качественно на рис. 3.1.
На рис. 3.1 видно, что при температуре, равной 0 К, энтропия вещества равна нулю. При повышении температуры энтропия плавно увеличивается, а в точках фазовых переходов имеет место скачкообразное увеличение энтропии, определяемое соотношением
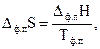 (3.14)
(3.14)
где Δ ф.пS, Δф.пН и Тф.п − изменения энтропии, энтальпии и температура фазового перехода соответственно.
Энтропию вещества B в стандартном состоянии обозначают как 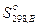 . Для многих веществ абсолютные значения стандартных энтропий определены и приводятся в справочных изданиях.
. Для многих веществ абсолютные значения стандартных энтропий определены и приводятся в справочных изданиях.
Энтропия, так же как внутренняя энергия и энтальпия, является функцией состояния, поэтому изменение энтропии системы в процессе не зависит от его пути и определяется только начальным и конечным состояниями системы. Изменение энтропии в ходе химической реакции (3.10) может быть найдено как разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ:
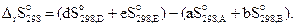 (3.15)
(3.15)
Понятие энтропии используется в одной из формулировок второго закона термодинамики: в изолированных системах могут самопроизвольно протекать только процессы, идущие с увеличением энтропии (ΔS>0).Под изолированными системами понимаются системы, не обменивающиеся с окружающей средой ни веществом, ни энергией. Системы, в которых протекают химические процессы, к изолированным системам не относятся, т.к. они обмениваются с окружающей средой энергией (тепловой эффект реакции) и в таких системах могут протекать процессы и с уменьшением энтропии.
Пример 3.7.Рассчитать стандартную энтропию реакции
SO2(г) + 2H2S(г) = 3S(т) + 2Н2О(ж), если стандартные энтропии оксида серы (IV), сероводорода, серы и воды составляют 248,1; 205,64; 31,88 и 69,96 Дж/(моль• К) соответственно.
Решение. На основании уравнения (3.15) можно записать:
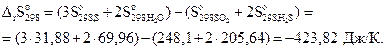
Энтропия в данной реакции уменьшается, что связано с образованием твердого и жидкого продуктов из газообразных веществ.
Пример 3.8.Не производя вычислений, определить знак изменения энтропии в следующих реакциях:
1) NH4NO3(к) = N2O(г) + 2Н2О(г),
2) 2Н2(г) + О2(г) = 2Н2О(г),
3) 2Н2(г) + О2(г) = 2Н2О(ж).
Решение. В реакции (1) 1 моль NH4NO3 в кристаллическом состоянии образует 3 моль газов, следовательно, DrS1>0.
В реакциях (2) и (3) уменьшается как общее число молей, так и число молей газообразных веществ. Следовательно, DrS2 <0 и DrS3<0. При этом уменьшение энтропии в реакции (3) больше, чем в реакции (2) , так как Sо(H2O (ж)) < Sо(H2O(г)).
Энергия Гиббса (изобарно-изотермический потенциал). Во многих случаях самопроизвольные процессы в природе протекают при наличии разности потенциалов, например, разность электрических потенциалов обусловливает перенос заряда, а разность гравитационных потенциалов – падение тела. Эти процессы заканчиваются при достижении минимума потенциала. Движущей силой химических процессов, протекающих при постоянных давлении и температуре, является изобарно-изотермический потенциал, называемый энергией Гиббсаи обозначаемый G. Изменение энергии Гиббса в химическом процессе определяется соотношением
ΔG = ΔH –TΔS, (3.16)
где ΔG – изменение энергии Гиббса химического процесса; ΔH – изменение энтальпии химического процесса; ΔS – изменение энтропии химического процесса; Т – температура, К.
Уравнение (3.16) может быть представлено в следующем виде:
ΔH = ΔG + TΔS. (3.17)
Смысл уравнения (3.17) в том, что часть теплового эффекта реакции расходуется на совершение работы (ΔG), а часть рассеивается в окружающую среду (TΔS).
Энергия Гиббса является критерием принципиальной возможности самопроизвольного протекания реакции. Если в ходе реакции энергия Гиббса уменьшается, то процесс может протекать в данных условиях самопроизвольно:
ΔG < 0. (3.18)
Процесс в данных условиях неосуществим, если
ΔG > 0. (3.19)
Выражения (3.18) и (3.19) одновременно означают, что обратная реакция не может (3.18) или может (3.19) протекать самопроизвольно.
Реакция является обратимой, т.е. может протекать и в прямом, и в обратном направлениях, если
ΔG = 0. (3.20)
Уравнение (3.20) является термодинамическим условием химического равновесия.
Соотношения (3.18) –(3.20) применимы также к фазовым равновесиям, т.е. к случаям, когда в равновесии находятся две фазы (агрегатных состояния) одного и того же вещества, например лед и жидкая вода.
Энтальпийный и энтропийный факторы. Из уравнений (3.16) и (3.18) следует, что процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔS и ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов.
Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|.
Если энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составлящей, при условии, что |ΔH|>|TΔS|.
Влияние температуры на направление реакции. Температура влияет на энтальпийную и энтропийную составляющие энергии Гиббса, что может сопровождаться изменением знака энергии Гиббса этих реакций, а следовательно, и направления протекания реакций. Для ориентировочной оценки температуры, при которой происходит смена знака энергии Гиббса, можно пренебречь зависимостью ΔН и ΔS от температуры. Тогда из уравнения (3.16) следует, что изменение знака энергии Гиббса произойдет при температуре
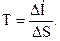 (3.21)
(3.21)
Очевидно, что смена знака энергии Гиббса с изменением температуры возможна только в двух случаях: 1) ΔН>0 и ΔS>0 и 2) ΔН<0 и ΔS<0.
Стандартная энергия Гиббса образования 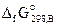 – это изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях.Энергия Гиббса образования простых веществ принимается равной нулю. Стандартные энергии Гиббса образования веществ можно найти в соответствующих справочниках.
– это изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях.Энергия Гиббса образования простых веществ принимается равной нулю. Стандартные энергии Гиббса образования веществ можно найти в соответствующих справочниках.
Энергия Гиббса химической реакции. Энергия Гиббса является функцией состояния, т.е. ее изменение в процессе не зависит от пути его протекания, а определяется исходным и конечным состояниями системы. Следовательно, энергию Гиббса химической реакции (3.10) можно рассчитать по формуле
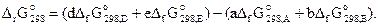
(3.22)
Отметим, что выводы о принципиальной возможности протекания реакции по величине ΔrG применимы только к тем условиям, для которых вычислено изменение энергии Гиббса реакции. Если условия отличаются от стандартных, то для нахождения ΔrG может быть использовано уравнение изотермы Вант-Гоффа, которое для реакции (3.10) между газами записывается как
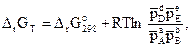 (3.23)
(3.23)
а между растворенными веществами –
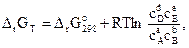 (3.24)
(3.24)
где 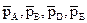 – парциальные давления соответствующих веществ; сА, сВ, сD, cE – концентрации соответствующих растворенных веществ; а, b, d, е – соответствующие стехиометрические коэффициенты.
– парциальные давления соответствующих веществ; сА, сВ, сD, cE – концентрации соответствующих растворенных веществ; а, b, d, е – соответствующие стехиометрические коэффициенты.
Если реагирующие вещества находятся в стандартном состоянии, то уравнения (3.23) и (3.24) превращаются в уравнение
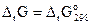 .
.
Пример 3.9. Установить возможность протекания реакции NH3(г) + HCl(г) = NH4Cl(к)в стандартных условиях при температуре 298,15 К, используя данные по стандартным энтальпиям образования и энтропиям.
| Функция | NH3(г) | HCl(г) | NH4Cl(к) |
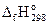 , кДж/моль , кДж/моль
| -46,19 | - 92,31 | -315,59 |
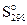 , Дж/(моль•К) , Дж/(моль•К)
| 192,5 | 186,68 | 94,5 |
Решение. На основании первого следствия закона Гесса найдём стандартную энтальпию реакции:
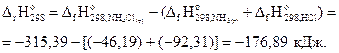
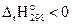 ; реакция экзотермическая, следовательно, энтальпийная составляющая благоприятствует протеканию реакции.
; реакция экзотермическая, следовательно, энтальпийная составляющая благоприятствует протеканию реакции.
Изменение энтропии реакции рассчитаем по уравнению
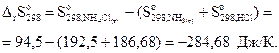
Реакция сопровождается уменьшением энтропии, значит, энтропийная составляющая противодействует протеканию реакции.
Найдём изменение энергии Гиббса процесса по уравнению (3.16):
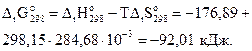
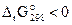 , таким образом, данная реакция может протекать самопроизвольно при стандартных условиях.
, таким образом, данная реакция может протекать самопроизвольно при стандартных условиях.
Пример 3.10.Используя данные по стандартным энтальпиям образования и энтропиям, определить, при какой температуре наступит равновесие в системе N2(г) + 3Н2(г) = 2NH3(г).
| Функция | NH3(г) | H2(г) | N2(г) |
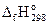 , кДж/моль , кДж/моль
| -46,19 | ||
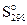 , Дж/(моль•К) , Дж/(моль•К)
| 192,5 | 130,6 | 191,5 |
Решение. Условием равновесия системы является ΔG=0. Для этого, используя соотношение (3.21), найдем температуру, при которой ΔG=0. Вычислим стандартные энтальпию и энтропию реакции:
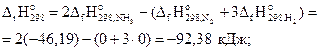
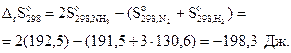
Энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию реакции, значит, при некоторой температуре возможна смена знака энергии Гиббса, т.е изменение направления протекания реакции.
Условие равновесия запишется следующим образом:
ΔG = ΔH –TΔS,
или, подставляя численные значения, получим
0 = - 92,38 – Т(-198,3) •10-3.
Следовательно, реакция будет находиться в состоянии равновесия при температуре
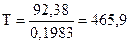 К.
К.
Ниже этой температуры реакция будет протекать в прямом направлении, а выше – в обратном.
Пример 3.11. При некоторой температуре Т эндотермическая реакция А® В практически идет до конца. Определить: а) знак DrS реакции; б) знак DG реакции В ® А при температуре Т; в) возможность протекания реакции В ® А при низких температурах.
Решение. а) Самопроизвольное протекание реакции А ® В указывает, что DG<0. Поскольку DН>0, то из уравнения
DG = DH - TDS следует, что DS>0; для обратной реакции В ® А DS<0.
б) Для реакции А ® В DG<0. Следовательно, для обратной реакции при той же температуре DG>0.
в) Реакция А ® В эндотермическая (DH<0), следовательно, обратная реакция В ® А экзотермическая. При низких температурах абсолютная величина члена TDS мала, так что знак DG определяется знаком DН. Следовательно, при достаточно низких температурах протекание реакции В ® А возможно.
Пример 3.12. Рассчитать величину энергии Гиббса и определить, возможна ли реакция CO + Cl2 ÛCOCl2 при температуре 700 К, если константа равновесия реакции при этой температуре равна 10,83 атм-1 и парциальные давления всех компонентов одинаковы и равны единице.
Решение. Взаимосвязь DrG0 и Кр реакции А + В Û С + D дается уравнением изотермы (3.22)
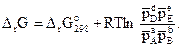
При стандартных условиях, когда парциальное давление каждого реагирующего вещества равно 1 атм, это соотношение примет вид
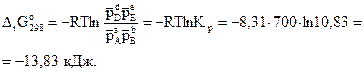
Следовательно, реакция при Т=700 К может протекать в прямом направлении самопроизвольно.
Вопросы и задачи для самостоятельной подготовки
1. Приведите численные значения давления и температуры в международной системе единиц, а также в атмосферах, миллиметрах ртутного столба и градусах Цельсия, соответствующие стандартным и нормальным условиям.
2. Какому условию удовлетворяют функции состояния? Что определяет изменение значения функции состояния в процессе?
3. Постоянством каких параметров характеризуются изобарно-изотермический и изохорно-изотермический процессы?
4. Сформулируйте первое начало термодинамики.
5. При каких условиях тепловой эффект процесса будет: а) равен изменению энтальпии этого процесса; б) равен изменению внутренней энергии процесса?
6. Химическая реакция протекает в герметичном реакторе. Изменением какой функции состояния будет определяться тепловой эффект реакции?
7. В ходе химической реакции температура системы повышается. Является этот процесс экзотермическим или эндотермическим? Какой знак (+) или (-) имеет изменение энтальпии этого процесса?
8. Сформулируйте закон Гесса.
9. Дайте определение понятия «стандартная энтальпия образования вещества».
10. Чему равны стандартные энтальпии образования молекулярного хлора и устойчивой при температуре 298 К модификации железа α-Fe?
11. Стандартная энтальпия образования белого фосфора равна нулю, а красного– (-18,41) кДж/моль. Какая из аллотропных модификаций более устойчива при температуре 25 оС?
12. Сформулируйте 1-е следствие закона Гесса.
13. Дайте определение понятия «стандартная энтальпия сгорания вещества».
14. Как связаны между собой стандартная энтальпия образования углекислого газа и стандартная энтальпия сгорания устойчивой при Т=298 К модификации углерода – графита?
15. Приведите 3 примера самопроизвольно протекающих химических процессов.
16. Перечислите признаки химического (истинного) равновесия.
17. Приведите примеры процессов, сопровождающихся: а) увеличением энтропии; б)уменьшением энтропии.
18. Какой знак должно иметь изменение энтропии самопроизвольно протекающей реакции, если ΔrН=0?
19. Какой знак должно иметь изменение энтропии реакции термического разложения карбоната кальция? Почему? Напишите уравнение реакции.
20. Какие термодинамические свойства участников реакции необходимо знать для решения вопроса о возможности протекания реакции?
21. Экзотермическая реакция между газами сопровождается увеличением объёма. Что можно сказать о возможности протекания такой реакции?
22. В каком из следующих случаев возможна смена направления протекания реакция при изменении температуры: а)DH<0, DS<0; б) DH>0, DS>0; в) DН<0, DS>0; г) DH>0, DS<0?
23. Найдите стандартную энтальпию реакции окисления газообразного оксида серы(IV) кислородом до газообразного оксида серы(VI). Стандартные энтальпии образования SO2 – (-297 кДж/моль) и SO3 – (-395 кДж/моль).
Ответ: -196 кДж.
24. Укажите знак изменения энтропии в следующих реакциях:
а)СО(Г)+Н2(Г)=С(Т)+Н2О(Г);
б) СО2(Г)+С(Т)=2СО(Г);
в)FeO(Т)+СО(Г)=Fe(Т)+CO2(Г);
г)Н2О(Ж)=Н2О(Г);
д) 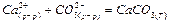 ;
;
Ответ: а)(-); б)(+); в)(~0); г) (+);д)(-).
25. Найдите стандартную энтропию реакции окисления газообразного оксида серы(IV) кислородом до газообразного оксида серы(VI). Стандартные энтропии образования SO2 – (248 Дж/(моль•К), SO3 – (256 Дж/( моль•К )), О2 – (205 Дж/( моль•К ).
Ответ: -189 Дж/К.
26. Найдите энтальпию реакции синтеза бензола из ацетилена, если энтальпия сгорания бензола составляет (-3302 кДж/моль), а ацетилена – (-1300 кДж/моль).
Ответ: - 598 кДж.
27. Найдите стандартную энергию Гиббса реакции разложения гидрокарбоната натрия. Возможно ли самопроизвольное протекание реакции при этих условиях?
| NaHCO3(кр) | Nа2 CO3(кр) | H2О(г) | C02(г) | |
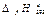 , кДж/моль , кДж/моль
| -947,4 | -1129 | -241,84 | -393,51 |
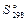 , Дж/(моль∙К) , Дж/(моль∙К)
| 102,1 | 136,0 | 188,74 | 213,6 |
Ответ: 30,88 кДж.
28. Найдите стандартную энергию Гиббса реакции 2Fe(Т)+3Н2О(Г)=Fe2O3(Т)+3Н2(Г) (реакции коррозии углеродистой стали водяным паром). Возможно ли самопроизвольное протекание реакции при этих условиях?
| Fe(Т) | Fe2O3(Т) | Н2(Г) | Н2О(Г) | |
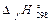 , кДж/моль , кДж/моль
| 0 | -821,32 | 0 | -241,84 |
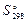 , Дж/(моль∙К) , Дж/(моль∙К)
| 27,15 | 89,96 | 130,6 | 188,74 |
Ответ: -54,45кДж.
29. При какой температуре наступит химическое равновесие в системе 2NO(г) + О2(г) Û 2NО2 (г)?
| NO(г) | O2(г) | NО2 (г) | |
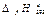 , кДж/моль , кДж/моль
| 90,37 | 0 | 33,89 |
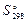 , Дж/(моль∙К) , Дж/(моль∙К)
| 210,62 | 205,03 | 240,45 |
Ответ: 777 К.
30. Найдите тепловой эффект процесса испарения 1 г воды (удельная теплота испарения) при температуре 298 К, если стандартная энтальпия образования Н2О(ж) составляет (-285,84 кДж/моль),а газообразной– (-241,84 кДж/моль).
Ответ: 2,44 кДж/г.
3.4.Задания для текущих и промежуточных контролей
Раздел I
1. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями:
I. 2C(гр)+О2(г) = 2СО(г); 2CO(г) + О2 = 2СО2(г), DrН° = -566 кДж.
II. C(гр) + О2(г) = СО2(г), DrН° = -393 кДж.
Найдите DfH°(CO).
Ответ: -110 кДж/моль.
2. Рассчитайте энтальпию образования и энтальпию сгорания монооксида углерода (СО), исходя из приведенных ниже реакций:
I. 2С(гр) + О2(г) = 2СО(г), DrН° = -220 кДж.
II. 2СО(г) + О2(г) = 2СО2(г), DrН° = -566 кДж.
Ответ: -110 кДж/моль; -283 кДж/моль.
3. Найдите стандартную энтальпию образования сульфита натрия из термохимического уравнения
4Na2SO3(кр)= 3Na2SO3(кр)+ Na2S(кр) – 181,1 кДж,
если 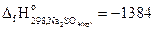 кДж/моль и
кДж/моль и 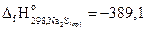 кДж/моль.
кДж/моль.
Ответ: -1090 кДж/моль.
4. Найдите стандартную энтальпию сгорания метана, исходя из реакции СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г), DrН°= -802 кДж.
Ответ: -802 кДж/моль.
5. Предскажите, положительным или отрицательным будет
изменение энтропии системы в реакциях:
а) Н2О(ж) ® Н2О(г) (при температуре 25 °С);
б) СаСО3(т) ® СаО(т) + СО2(г);
в) N2(г) + 3Н2(г) = 2NH3(г);
г) N2(г) + О2(г) = 2NO(г);
д) Ag+(р-р) + Cl-(р-р) = AgCl(т).
Дайте объяснения, не производя расчетов.
Ответ: а) +; б) +; в) -; г) ~0; д) -.
6. Предскажите знак DS системы в каждом из следующих
процессов:
а) испарение 1 моль CCl4(ж);
б) Br2(г) → Br2(ж);
в) осаждение AgCl(т) при смешении NaCl(водн.) и AgNO3(водн.).
Дайте объяснения.
Ответ: а) +; б) -; в)-.
7. Пользуясь табличными значениями абсолютных значений энтропий веществ при стандартных условиях (S°), сравните значения абсолютных энтропий веществ при температуре 298 К в каждой из перечисленных ниже пар:
а) О2(г) и О3(г);
б) С(алмаз) и С(графит);
в) NaCl(т) и MgCl2(т).
Объясните причину различия S° в каждом случае.
8. Вычислите DrS° для реакций
а) N2(г) + 3Н2(г) = 2NH3(г); б) 2SO2(г) + О2(г) = 2SO3(г),
используя табличные значения абсолютных энтропий веществ при стандартных условиях.
Ответ: а) -197,74 Дж/К; б) -188,06 Дж/К.
9. Пользуясь табличными значениями абсолютных эн-
тропий (S°), вычислите DrS° для следующих процессов:
а) СО(г) + 2Н2(г) = СН3ОН(г);
б) 2НСl(г) + Br2(ж) = 2HBr(г) + Cl2(г);
в) 2NO2(г) = N2O4(г).
Согласуется ли в каждом случае знак величины DrS° с тем, который следует ожидать на основе качественных представлений? Ответы объясните.
Ответ: а) -218,83 Дж/К; б) 94,15 Дж/К; в) -175,77 Дж/К.
10. Стандартная энтальпия образования СО(г) составляет -110,5 кДж/моль. При сгорании 2 моль СО(г) выделилось 566 кДж теплоты. Вычислите 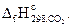
Ответ: -393,5 кДж/моль.
11. Определите количество теплоты, выделяющееся при гашении 100 кг извести водой: CaO(к) + H2O(ж) = Ca(OH)2(к), если стандартные теплоты образования CaO(к), H2O(ж), Ca(OH)2(к) равны соответственно -635,14; -285,84; -986,2 кДж/моль.
Ответ: -1165357,2 кДж.
12. Определите энтальпию разложения пероксида водорода (Н2О2) на воду и кислород, используя нижеприведенные данные:
SnCl2(р) + 2НCl(p) + H2O2(p) = SnCl4(p) + 2H2O(ж), DrН°=-393,3 кДж;
SnCl2(р) + 2HCl(p) + 1/2O2(г) = SnCl4(p) + H2O(ж), DrН°=-296,6 кДж.
Ответ: - 96,7 кДж.
13. Вычислите количество теплоты, которое выделяется при производстве 106 кг аммиака в сутки, если
N2(г) + 3Н2(г) = 2NH3(г), DrН° = -92 кДж.
Ответ: -2,7.109 кДж.
14. Определите 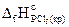 , исходя из следующих данных:
, исходя из следующих данных:
Р4(кр) + 6Cl2(г) = 4РСl3(ж), DrН° = -1272,0 кДж;
PCl3(ж) + Cl2(г) = PCl5(кр), DrН° = -137,2 кДж.
Ответ: -455,2 кДж/моль.
15. Вычислите изменение энтальпии реакции при стандартных условиях: Н2(г) + 1/3О3(г) = Н2О(г), исходя из следующих данных:
2О3(г)=3О2(г), DrН°=-288,9 кДж,
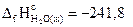 кДж/моль.
кДж/моль.
Ответ: -289,95 кДж.
16. Рассчитайте стандартную энтальпию реакции образования PbO, используя следующие данные:
1) 2Pb(кр)+О2(г)=2PbO2(кр) – 553,2 кДж;
2) 2PbO2(кр)= 2PbO(кр) )+О2(г) + 117,48 кДж.
Ответ: -217,86 кДж/моль.
17. Рассчитайте стандартную энтальпию реакции образования CuCl, используя следующие данные:
1) CuCl2(кр)+Cu(кр)=2 CuCl(кр) – 63,5 кДж;
2) Cu(кр)+ Cl2(г)= CuCl2(кр) – 205,9 кДж.
Ответ: 134,7 кДж/моль.
18. Вычислите ΔfH° метилового спирта в жидком состоянии, зная следующие данные:
Н2(г) + 1/2О2(г) = Н2О(ж), DrН° = -285,8 кДж;
С(гр) + О2(г) = СО2(г), DrН° = -393,7 кДж;
СН3ОН(ж) + 3/2О2(г) = СО2(г) + 2Н2О(ж), DrН° = -715,0 кДж.
Ответ: -250,3 кДж/моль.
19. Стандартные энтальпии сгорания бензола и ацетилена равны соответственно -3270 и -1302 кДж/моль. Определите DrH° превращения ацетилена в бензол: 3С2Н2(г) = С6Н6(г).
Ответ: -636 кДж.
20. Определите стандартную энтальпию образования оксида железа (III), если при окислении 20 г железа выделилось 146,8 кДж теплоты.
Ответ: -822 кДж/моль.
21. Вычислите количество теплоты, которое выделяется при получении 22,4 л аммиака (н.у.), если
N2(г) + 3Н2(г) = 2NH3(г), DrН° = -92 кДж.
Ответ: -46 кДж.
22. Определите ΔfH° этилена, используя следующие дан
ные:
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(г)-1323 кДж;
С(гр)+ О2(г) = СО2(г)-393,7 кДж;
Н2(г)+1/2О2(г)=Н2О(г)-241,8 кДж.
Ответ: 52 кДж/моль.
23.Рассчитайте энтальпию реакции F(г)+Li(г)=F-(г)+ Li+(г),
если F(г) + е = F-(г) -322 кДж/моль;
Li(г) = Li+(г) + е +520 кДж/моль.
Ответ: 198 кДж.
24. Рассчитайте стандартную энтальпию реакции образования Hg2Br2, используя следующие данные:
1) HgBr2(кр)+ Hg(ж)= Hg2Br2 (кр) – 37,32 кДж;
2) HgBr2 (кр)= Hg (ж)+ Br2(ж) +169,45 кДж.
Ответ: -206,77 кДж/моль.
25. Рассчитайте стандартную энтальпию реакции образования гидрокарбоната натрия, используя следующие данные:
2NaНСO3(кр)= Na2СO3(кр)+ СО2(г) +Н2О(г) + 130,3 кДж,
если 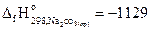 кДж/моль;
кДж/моль;
С(гр)+О2(г)=СО2(г)– 393,7 кДж; Н2(г)+1/2О2(г)=Н2О(г)-241,8 кДж.
Ответ: -947,4 кДж/моль.
26. Рассчитайте стандартную энтальпию реакции образования СaСO3(кр) , используя следующие данные:
Ca(OH)2(к)+ СО2(г)= СaСO3(кр)+173,9 кДж;
С(гр)+О2(г)=СО2(г) – 393,7 кДж;
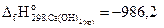 кДж/моль.
кДж/моль.
Ответ: -1206 кДж/моль.
27. Определите стандартную энтальпию образования оксида железа (III), если при реакции
2Fe + Al2O3 = Fe2O3 + 2Al
на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты, 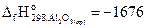 кДж/моль.
кДж/моль.
Ответ: -823 кДж/моль.
28. Какое количество теплоты необходимо затратить для получения 11,2 кг железа, если в соответствии с термохимическим уравнением FeO(т) + Н2(г) = Fe(т) + Н2О(г)+ 23 кДж.
Ответ: 4600 кДж.
29. Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита составляет -393,51 кДж/моль, а тепло-
та фазового перехода С(графит) ® С(алмаз) составляет
1,88 кДж/моль.
Ответ: -395,39 кДж/моль.
30. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в черный фосфор, если известно,
что стандартные энтальпии образования красного и чёрного фосфора составляют -18,41 и -43,20 кДж/моль соответственно.
Ответ: -800 кДж.
Раздел II
Вычислите стандартное изменения энергии Гиббса химической реакции при температуре 25 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений и установите возможность самопроизвольного протекания реакции:
1. 4NH3г + 5O2г = 4NOг + 6H2Oг.
Ответ: -955,24 кДж; реакция возможна.
2. SO2г + 2H2Sг = 3Sк + 2H2Oж.
Ответ: -107,25 кДж; реакция возможна.
3. 2H2Sг + 3O2г = 2H2Oг + 2SO2г.
Ответ: -990,48 кДж; реакция возможна.
4. 2NOг + O3г + H2Oж = 2HNO3ж.
Ответ: - 260,94 кДж; реакция возможна.
5. 3Fe2O3к + COг = 2Fe3O4к + CO2г.
Ответ: - 64,51 кДж; реакция возможна.
6. 2СН3ОНж + 3О2г = 4Н2Ог + 2СО2г.
Ответ: - 1370,46 кДж; реакция возможна.
7. СН4г + 3СО2г = 4СОг + 2Н2Ог.
Ответ: 228,13 кДж; реакция невозможна.
8. Fe2O3к + 3COг = 2Feк + 3CO2г.
Ответ: -31,3 кДж; реакция возможна.
9. С2Н4г + 3О2г = 2СО2г + 2Н2Ог.
Ответ: -1313,9 кДж; реакция возможна.
10. 4NH3г + 3O2г = 6H2Oг + 2N2г.
Ответ: -1305,69 кДж; реакция возможна.
11. 4NO2г + O2г + 2H2Oж = 4HNO3ж.
Ответ: -55,08 кДж; реакция возможна.
12. 2HNO3ж + NOг = 3NO2г + H2Oж.
Ответ: -7,71 кДж; реакция возможна.
13. 2С2Н2г + 5О2г = 4СО2г + 2Н2Ог.
Ответ: -2452,81 кДж; реакция возможна.
14. Fe3O4к + 4H2г = 3Feк + 4H2Oг.
Ответ: 99,7 кДж; реакция невозможна.
15. 2Fe2O3к + 3Cк = 4Feк + 3СО2г.
Ответ: 297,7 кДж; реакция невозможна.
16. Fe3O4к + 4COг = 3Feк + 4CO2г.
Ответ: -14,88 кДж; реакция возможна.
17. 2H2Sг + O2г = 2H2Oж + 2Sк.
Ответ: -407,4 кДж; реакция возможна.
18. Fe2O3к + 3H2г = 2Feк + 3H2Oг.
Ответ: 54,47 кДж; реакция невозможна.
Вычислите стандартное изменение энергии Гиббса химической реакции при температуре 25 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений и определите, при какой температуре наступит равновесие в системе.
19. 4HClг + O2г ↔ 2Cl2г + 2H2Oж.
Ответ: -93,1 кДж; ~552 К.
20. Cl2г + 2HIг ↔ I2к + 2HClг.
Ответ: -194,0 кДж; ~1632 К.
21. SO2г + 2COг ↔ 2CO2г + Sк.
Ответ: -214,24 кДж; ~1462 К.
22. СН4г + 2Н2Ог ↔ СО2г + 4Н2г.
Ответ: 113,8 кДж; ~959 К.
23. СОг + 3Н2г ↔ СН4г + Н2Ог.
Ответ: -142,36 кДж; ~ 963 К.
Вычислите изменение энергии Гиббса химической реакции при температуре 350 °С по значениям стандартных энтальпий образования и абсолютных энтропий химических соединений. Температурной зависимостью DfH° и S° пренебречь. Установите возможность самопроизвольного протекания реакций:
24. 2РН3г + 4О2г = Р2О5к + 3Н2Ог.
Ответ: 1910,47 кДж; реакция возможна.
25. Cl2г + SO2г + 2H2Oж = H2SO4ж + 2HClг.
Ответ: -80,0 кДж; реакция возможна.
26. Р2О5к + 5Ск = 2Рк + 5СОг.
Ответ: 860,0 кДж; реакция невозможна.
27. 2COг + SO2г = Sк + 2CO2г.
Ответ: -154,4 кДж; реакция возможна.
28. СО2г + 4Н2г = СН4г + 2Н2Ог.
Ответ: -57,9 кДж; реакция возможна.
29. NOг + O3г = O2г + NO2г.
Ответ: -196,83 кДж; реакция возможна.
30. СН4г + 2О2г = СО2г + 2Н2Ог.
Ответ: -798,8 кДж; реакция возможна.
Дата добавления: 2016-10-07; просмотров: 36651;










