МАССООБМЕННЫЕ ПРОЦЕССЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
В химической технологии широко распространены и имеют большое значение массообменные процессы.
Сущность любого массообменного процесса состоит в переходе одного или нескольких компонентов смеси из одной фазы в другую при взаимодействии этих фаз.
Подавляющее большинство массообменных процессов протекает при непосредственном контакте фаз, причём такие процессы можно разделить на 2 группы:
1. Процессы со свободной (подвижной) границей раздела фаз.
К ним относятся:
▫ абсорбция газов и паров жидкостями;
▫ ректификация жидких смесей;
▫ экстракция жидкостная, то есть извлечение вещества, растворённого в одной жидкости, другой жидкостью.
2. Процессы с фиксированной (неподвижной) границей раздела фаз или процессы с участием твёрдой фазы.
К ним относятся:
▫ адсорбция газов и паров твёрдым поглотителем;
▫ растворение твёрдых веществ в жидкостях и экстрагирование жидкостями отдельных компонентов из твёрдой фазы – выщелачивание;
▫ кристаллизация, то есть выделение твёрдых веществ из растворов и расплавов;
▫ сублимация (возгонка) твёрдых веществ;
▫ сушка, то есть удаление жидкости из твёрдых тел.
Как и прежде, рассматриваться будут не специальные, а только основные процессы и аппараты, то есть процессы и аппараты, общие для различных отраслей химической промышленности.
Например, упомянутый процесс абсорбции широко распространён как в технологии неорганических веществ, так и в органическом синтезе.
Основные задачи, решаемые с помощью массообменных процессов в химической технологии:
▫ извлечение компонентов из смесей с получением или целевых продуктов, или полупродуктов;
▫ очистка различных веществ или сред от загрязняющих компонентов.
Например, синтез аммиака осуществляют из азотоводородной смеси, которую получают разделением воздуха и конверсией природного газа. При этом образуется смесь газов: N2 + H2 + CO + CO2 + H2S + NO+ NO2. Серо- и кислородсодержащие компоненты этой смеси являются ядом для катализатора синтеза аммиака, в связи с чем их из смеси извлекают. Но извлекаемые компоненты сами по себе полезны. (Кто-то сказал, что «грязь – это полезное вещество, только лежит не там, где надо»). Так, выделив СО2, есть возможность получать «сухой лёд», или направить диоксид углерода на синтез карбамида. Так рождается безотходная технология.
В подавляющем большинстве случаев производственные установки химической промышленности создают по блок-схеме:
 |
Очевидно, массообменные процессы играют определяющую роль на 1-ой и 3-ей стадиях производства.
Без надлежащей подготовки сырья не достигается требуемая степень конверсии в реакторе; без надлежащего разделения реакционной смеси не приходится говорить о качестве продукции.
Подсчитано, что на долю оборудования для массообменных процессов в химической промышленности приходится примерно 50 % всех капитальных вложений.
Завершая вводную часть, отмечу особую экологическую роль массообменных процессов очистки в охране окружающей среды от вредных промышленных выбросов и стоков. Причём выбросов не только самой химической промышленности, но и электроэнергетики, электроники, металлургии, автомобилестроения и проч.
Основные понятия и определения
Определим основные понятия теории массообмена.
Тело или группу тел, находящихся во взаимодействии и мысленно обособляемых от окружающей среды, называют системой.
Если внутри системы нет поверхностей раздела, отделяющих части системы друг от друга, то такая система называется гомогенной. Если же такие поверхности раздела имеются, то система называется гетерогенной.
Термином фаза обозначается совокупность всех гомогенных частей системы, отделённая от других частей поверхностью раздела.
Например, смесь газов или раствор состоит из одной фазы, а система «лёд – вода – водяной пар» состоит из трёх фаз, независимо от того, находится ли лёд в виде одного куска или в виде нескольких.
Любая гетерогенная система содержит не менее двух фаз.
Компонентом называется каждое содержащееся в системе химически однородное вещество, которое может быть выделено из неё и может существовать в изолированном виде длительное время.
Например, для водного раствора хлорида натрия компонентами являются вода и хлорид натрия. Ионы же натрия и хлора не могут рассматриваться как компоненты; ни те, ни другие не могут существовать как отдельные вещества.
Предположим, что во взаимодействии находятся жидкая и газовая (или паровая) фазы, а некоторый компонент может переходить из одной фазы в другую.
Условимся здесь обозначать содержание переносимого компонента в жидкой фазе символом «х», а содержание этого же компонента в газовой (паровой) фазе символом «у».
Фактические концентрации «х» и «у» называют действительными или рабочими концентрациями компонента в фазах.
В соответствии со II законом термодинамики состояние замкнутой системы при взаимодействии двух фаз стремится к равновесию, то есть к состоянию, при котором количество молекул компонента, переходящих, например, из жидкости в газ и из газа в жидкость за определённый интервал времени одинаково.
Следовательно, при данной температуре и при данном давлении в условиях равновесия некоторой концентрации компонента в жидкой фазе «х» соответствует строго определённая концентрация этого же компонента «у*» в газовой (паровой) фазе. И наоборот, некоторой концентрации компонента в газовой (паровой) фазе «у» соответствует строго определённая при данной температуре и при данном давлении концентрация этого же компонента «х*» в жидкой фазе.
Связь между концентрациями компонента в фазах при равновесии выражается уравнениями равновесия, которые, в самой общей форме, имеют вид:
 . (1.1)
. (1.1)
Примечание: «звёздочка» у символов концентрации «х» или «у» – условный значок, показывающий, что речь идёт именно о равновесной концентрации.
Отклонение состояния системы от равновесия, то есть условие
 (1.2)
(1.2)
является необходимым и достаточным условием для протекания массообменного процесса.
Способность рассматриваемого компонента к выходу из данной фазы (испарением, кристаллизацией и т. п.) характеризует химический потенциал — m. Переход компонента может происходить самопроизвольно только из фазы, в которой его химический потенциал больше, в фазу с меньшим химическим потенциалом.
Если внутри фазы возникает градиент химического потенциала, то количество компонента "А" (пА), переносимого за единицу времени через поверхность площадью dS, пропорционально градиенту химического потенциала и составляет
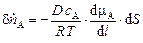 , (1.3)
, (1.3)
где D – коэффициент молекулярной диффузии [м2/с];
сА – молярная концентрация компонента "А" [(моль А)/м3];
l – расстояние по нормали к поверхности площадью dS.
Выражая химический mА через молярную долю компонента "А" (хА) и коэффициент активности (gА) посредством уравнения
 , (1.4)
, (1.4)
можно получить:
 . (1.5)
. (1.5)
Если принять, что коэффициент активности gА не зависит от молярной доли хА, то d lngA/dxA = 0, и тогда
 . (1.6)
. (1.6)
Последнее уравнение выражает известный 1-ый закон Фика[1] молекулярной диффузии, причём в нём градиент химического потенциала приближённо заменён градиентом концентрации.
Знак «минус» указывает на то, что перенос компонента происходит в направлении уменьшения концентрации.
Заметим, что закон Фика молекулярной диффузии является аналогом закона Ньютона внутреннего трения и закона Фурье теплопроводности.
Итак, поскольку химические потенциалы компонентов неидеальных смесей являются сложными функциями состава, то при анализе процессов массопередачи обычно рассматривают изменение не химических потенциалов, а изменение концентраций компонентов. Это оправдывается тем, что концентрации компонентов поддаются непосредственному определению (измерению) и чаще всего рассматриваются как параметры состоянии двух- и многокомпонентных систем.
Дата добавления: 2019-09-30; просмотров: 219;










