ЭЛЕКТРОЛИЗ РАСТВОРА ХЛОРИДА НАТРИЯ
Электролиз раствора NaCl — наиболее простой и экономичный метод одновременного получения трех важнейших химических продуктов — хлора, водорода и гидроксида натрия с использованием дешевого и доступного природного сырья. Электролитическое получение хлора, водорода и щелочей — самое крупнотоннажное электрохимическое производство. Суммарная реакция в электролизере может быть выражена уравнением
2NaCl + 2Н2О ® С12 + 2NaOH + Н2
Хлор применяется в больших масштабах как исходный материал для производства хлорорганических растворителей, пластических масс, синтетических каучуков, химических волокон, ядохимикатов. В металлургии хлор применяют для хлорирующего обжига руд, в текстильной и целлюлозно-бумажной промышленности для очистки и отбелки целлюлозы.
Исходным материалом для электролитического производства хлора, гидроксида натрия и водорода служит очищенный от примесей концентрированный раствор (рассол), содержащий 305— 310 г/дм3 NaCl. Сырьем для получения рассола могут служить каменная соль, озерная соль, природные подземные растворы NaCl.
Электролиз раствора NaCl осуществляют двумя методами, различными по электрохимическим процессам на электродах и по аппаратурному оформлению: 1) электролиз с твердым катодом и фильтрующей диафрагмой и 2) электролиз без диафрагмы с жидким ртутным катодом. Газообразные продукты — хлор и водород при любом способе отличаются высокой чистотой. При электролизе с жидким ртутным катодом и третий продукт — раствор гидроксида натрия имеет высокую концентрацию NaOH и является химически чистым. Благодаря чистоте получаемых продуктов, простому и компактному аппаратурному оформлению, а также несложности, одностадийности химико-технологической системы электролиз раствора NaCl сейчас единственный в мире способ производства хлора и основной способ производства гидроксида натрия.
Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой. Выход продуктов электролиза раствора NaCl зависит от селективности электрохимических реакций на электродах и от химических реакций в объеме электролита. При прохождении постоянного электрического тока через электролит, содержащий ионы Na+, Cl–, H+ и ОН–, последовательность разряда этих ионов на электродах первоначально определяется величинами их стандартных электродных потенциалов. На катоде происходит исключительно выделение водорода, поскольку потенциал разряда натрия имеет высокое значение.
Материалом для катода служит сталь, на которой водород выделяется с относительно невысоким перенапряжением (0,3 В). В реальных условиях электролиза (концентрированный раствор NaCl, содержащий NaOH, температура 90°С) фактический потенциал выделения водорода составляет около —0,845 В. Снижения потенциала до 0,3—0,4 В можно достигнуть применением пористых графитовых катодов, для упрочнения и гидрофобизации пропитанных политетрафторэтиленом и активированных солями меди или серебра.
Материалом для анодов ранее служил графит. Сейчас применяют оксидно-рутениевые аноды (композиция из оксидов титана и рутения, нанесенных на титановую основу). Оксидно-рутениевые аноды более прочны, чем графитовые, и не реагируют с кислородом, образующимся вследствие побочной анодной реакции. Стандартный потенциал хлора более электроположителен, чем ОН-ионов, но на угольных и оксидно-рутениевых анодах ОН-ионы разряжаются с большим перенапряжением; поэтому основной анодный процесс — выделение хлора. Выделению хлора на аноде способствует повышение концентрации NaCl в исходном электролите и повышение температуры, так как в этих условиях понижается равновесный потенциал разряда С1–, а также фактический электродный потенциал ввиду уменьшения перенапряжения разряда хлорид-ионов.
В промышленных условиях при электролизе раствора NaCl наряду с основными электрохимическими реакциями идут побочные— на аноде и в объеме электролита.
На аноде образуется кислород, при взаимодействии которого с углеродом графитового анода образуется диоксид углерода.
В объеме электролита анодного пространства в результате гидролиза хлора идут химические реакции с образованием побочных продуктов гипохлорита, хлората и хлорида натрия.
В межэлектродном пространстве, куда вследствие диффузии попадают ионы ОН–, идет реакция
HOCI + NaOH ® NaOCl + Н2О
На аноде происходит электрохимическое окисление ионов ОС1– с образованием хлората:
6ОС1– + 3Н2О – 6е– ® 2С1О3– + 4С1– + 3О2 + 6Н+
Побочные реакции снижают выход по току основных продуктов и повышают расходные коэффициенты по электроэнергии. Условия электролиза и конструкция электролизеров направлены на минимальное протекание побочных реакций и достижение максимального выхода по току целевых продуктов. Для этого электролиз реализуют в электролизерах непрерывного действия с вертикальными фильтрующими диафрагмами при противотоке движения электролита и ОН-ионов. Схема элемента электролизера представлена на рис. 4.
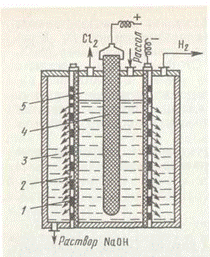
Корпус ванны, обычно прямоугольный, разделен на катодное и анодное пространства пористой диафрагмой из асбеста, модифицированного полимерными веществами. Диафрагма плотно прилегает к перфорированному (с множеством отверстий) или сетчатому стальному катоду. В современных электролизерах катоды имеют гребенчатую разветвленную форму с целью развития поверхности. В анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол подают в анодное пространство и вследствие гидростатического давления он фильтруется через диафрагму и катод в катодное пространство. Из катодного пространства непрерывно отводят водород и раствор гидроксида натрия, а из анодного пространства — хлор. В образующемся хлор-газе содержится 95—96% С12. Хлор-газ охлаждают до 20°С (при этом конденсируется вода) и дополнительно сушат промывкой концентрированной серной кислотой. Для транспортировки хлор сжижают под давлением 1—1,2 МПа (или при —5—25°С под давлением 0,3—0,6 МПа) и перевозят в баллонах или цистернах. Катодный продукт — раствор гидроксида натрия содержит 120—140 г/дм3 NaOH и 170—180 г/дм3 не разложившегося NaCl. Раствор выпаривают, при этом NaCl переходит в твердую фазу, так как его растворимость резко понижается с увеличением концентрации NaOH.
B последние годы для электролиза раствора NaCl начали применять фильтрпрессные электролизеры большой мощности с биполярными электродами.
Электролиз раствора хлорида натрия с ртутным катодом. На ртутном катоде водород выделяется с большим перенапряжением; потенциал разряда иона Н+ на ртутном катоде составляет 1,7 — 1,85 В. Натрий выделяется на ртутном катоде с большим эффектом деполяризации, т. е. потенциал разряда иона Na+ на ртути много ниже стандартного и равен 1,23 В. Явление деполяризации ртутного катода обеспечивается тем, что разряд ионов натрия происходит с образованием химического соединения — амальгамы натрия, которая непрерывно отводится с поверхности анода, растворяясь в избытке ртути. На перфорированном графитовом (или оксидно-рутениевом) электроде выделяется хлор.
Амальгаму натрия, содержащую 0,1—0,3% Na, выводят из электролизера и разлагают нагретой водой в другом реакторе-разлагателе.
Схема электролизера с ртутным катодом показана на рис. 5.
| |
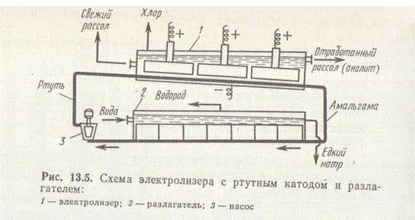
Глубоко очищенный концентрированный раствор NaCl подают в наклонный удлиненный электролизер, по дну которого самотеком, противотоком рассолу, движется ртуть, служащая катодом. Над ртутью расположен горизонтальный оксидно-рутениевый (или перфорированный графитовый) анод, погруженный в рассол. Хлор подают на осушку, а обесхлоренный рассол после очистки от ртути, до насыщения каменной солью и реагентной очистки от примесей вновь возвращается в электролизер. Амальгама натрия из электролизера перетекает в наклонный реактор-разлагатель, где движется противотоком дистиллированной воде, подаваемой в количестве, обеспечивающем получение 45%-ного раствора NaOH. На дне разлагателя размещены гребенчатые графитовые плиты, образующие с амальгамой короткозамкнутый гальванический элемент NaHgn[NaОH]C. Раствор гидроксида натрия в сепараторах отделяют от водорода и передают потребителям. Ртуть, вытекающая из разлагателя, ртутным насосом перекачивают в электролизер.
Метод электролиза с ртутным катодом требует особо тщательной очистки исходного циркулирующего рассола, так как примеси магния, железа, кальция и других металлов снижают перенапряжение водорода на ртутном катоде, что может привести к нарушению катодного процесса и к взрывам. Для подавления разряда ионов Н+ применяют высокую плотность тока.
Электролиз с ртутным катодом дает, химически чистые растворы гидроксида натрия. Но использование ртути вредно для здоровья людей. Для получения химически чистых растворов NaOH начали применять электролиз раствора NaCl с ионообменной (катионообменной) мембраной, разделяющей катодное и анодное пространства. Этот метод более сложен по аппаратурному оформлению и эксплуатации аппаратуры, но он значительно безопаснее, чем ртутный. Мембранный метод электролиза, так же как и диафрагменный, может считаться малоотходным технологическим процессом.
Дата добавления: 2016-09-26; просмотров: 40873;










