Химические источники тока
В качестве химических источников используют гальванические элементы, аккумуляторы и топливные элементы. Гальваническими элементами называются одноразовые химические источники тока. Они отдают во внешнюю цепь энергию, запасенную в активных массах электродов в процессе изготовления, при этом имеют место необратимые химические процессы.
Наибольшее применение для питания аппаратуры связи нашли сухие элементы марганцево-цинковые (МЦ) и воздушно-марганцево-цинковые (ВМЦ). Конструктивно они выполняются в виде стаканчиков и галет.
Отрицательным электродом в гальванических элементах МЦ и ВМЦ является цинк, выполненный в виде коробки (стакана), служащей сосудом элемента при «стаканчиковой» конструкции и в виде пластины при галетной конструкции.
Активным материалом положительного электрода является двуокись марганца (MnO2), которая для повышения электропроводности смешивается с графитом. Смесь располагается вокруг угольного электрода.
Между положительным и отрицательным электродами помещается электролит — раствор нашатыря (NH4Cl), для сгущения которого добавляется мука или крахмальный клейстер.
ЭДС гальванического элемента зависит от материалов электродов и от концентрации электролита, и не зависит от размеров элемента.
Для МЦ и ВМЦ элементов ЭДС имеет величину 1,3—1,6 В в начале разряда.
Электрический ток во внешней цепи обусловлен переносом электронов с отрицательного электрода на положительный, а внутри элемента переносом ионов электролита.
В процессе разряда гальванического элемента ионы водорода соединяются с ионами; кислорода, в результате, чего образуются молекулы, воды (Н2О).
Элементы ВМЦ содержат активированный уголь, значительно повышает интенсивность превращения ионов водорода в молекулы воды. Благодаря этому, ВМЦ элементы обладают большей емкостью, чем МЦ элементы при одинаковых габаритах.
Емкость гальванических элементов и аккумуляторов выражается в ампер-часах (А*ч), т. е, определяется как произведение тока, нагрузки на время, в течение которого элемент отдает электрическую энергию. Емкость элемента зависит от его конструкции (от количества активных материалов электродов, и электролита), от температуры окружающей среды (с понижением температуры емкость уменьшается) и от тока нагрузки (при увеличении тока нагрузки емкость уменьшается, так как часть активных материалов не успевает участвовать в реакциях). Удельная емкость МЦ элементов, т. е. количество А*ч на килограмм массы составляет (35—40) А*ч/кг. Удельная энергия МЦ элементов, т.е. количество Вт*ч на килограмм массы составляет (45—60) Вт*ч/кг, а для ВМЦ— (55—60) Вт*ч/кг.
Недостатками МЦ и ВМЦ сухих элементов и батарей являются: саморазряд их в процессе хранения, большие пределы изменения напряжения при разряде, низкая удельная энергия на единицу массы и объема.
Значительно лучше по своим техническим и эксплуатационным характеристикам окисно-ртутные элементы РЦ, у которых отрицательным электродом является цинк, а положительным — окись ртути. В качестве электролита используют раствор, едкого калия, ЭДС такого элемента составляет 1,35 В. Удельная энергия на единицу массы — 68 Вт*ч/кг, удельная энергия на единицу, объема -300 Вт*ч/дм3 (вместо105 Вт*ч/дм3 для ВМЦ элементов). Они имеют значительно меньшее внутреннее сопротивление. Однако они значительно дороже МЦ и ВМЦ элементов.
Ввиду дефицитности и высокой стоимости цинка желательно использовать в качестве отрицательного электрода какой-либо другой металл, например, железо. Железо — угольные щелочные элементы ВДЖ применяются для питания радиоустройств в труднодоступных для обслуживания местностях. Однако замена цинка железом приводит к уменьшению ЭДС элемента. Начальное напряжение ВДЖ элемента 0,75 В, напряжение в конце разряда - 0,45 В. Элементы ВДЖ допускают длительное хранение и нормально работают при температурах выше 0°С. Удельная энергия на единицу объема и массы ВДЖ элементов выше, чем у ВМЦ элементов.
В настоящее время ведутся разработки по улучшению технических и эксплуатационных характеристик топливных элементов. Они, как и гальванические элементы, преобразуют химическую энергию в электрическую. В отличие от последних, запас энергии, у которых сосредоточен внутри самого элемента, в топливных элементах осуществляется непрерывная подача активных веществ из внешних хранилищ в зону, где происходит электрохимическая реакция и отвод продуктов, получившихся при этой реакции.
Аккумуляторы
Аккумулятором называют прибор многократного действия, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию.
Действие аккумуляторов, как и гальванических элементов, основано на обмене электронов между материалами электродов при активном участии электролита. Поэтому, аккумуляторы классифицируются по виду электролита (кислотные, щелочные), по материалу электродов (свинцовые, кадмиево-никелевые, серебряно-цинковые и другие), по конструкции (ламельные, безламельные, герметизированные и др.)
В аккумуляторах осуществляются окислитильно-восстановительные процессы при замкнутой их внешней цепи. При зарядке аккумуляторов в процессе электролиза, на положительном электродепротекает реакция окисления, а на отрицательном электроде реакция восстановления. При разрядке аккумуляторов, реакции протекают в обратном порядке. Окислитильно-восстановительные процессы в аккумуляторах обратимы, благодаря чему возможны многократные циклы заряд-разряд аккумулятора.
Положительный электрод кислотного аккумулятора состоит из свинцовых пластин, покрытых слоем двуокиси свинца PbO2; отрицательный электрод состоит из чистого свинца, находящегося в сильно раздробленном состоянии (так называемый губчатый свинец). Оба электрода помещены в сосуд, заполненный электролитом – раствором серной кислоты в дистилированной воде. В результате взаимодействия серной кислоты с окислами свинца на электродах образуется слой сернокислого свинца (сульфат свинца).
В процессе зарядки аккумулятора, когда его подключают к источнику постоянного тока, сернокислый свинец на положительных пластинах превращается в двуокись свинца, а на отрицательных пластинах – в свинец.
Химические реакции при зарядке и разрядке протекают согласно с уравнением:
PbO2 + 2H2SO4 + Pb 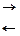 PbSO4 + 2H2O + PbSO2
PbSO4 + 2H2O + PbSO2
где левая часть уравнения характеризует заряженные, а правая - разряженные пластины. Одновременно с изменением состава электродов аккумулятора изменяется и концентрация серной кислоты, а именно при зарядке она повышается, а при разрядке понижается.
Типовая конструкция кислотных аккумуляторов такая, что все отрицательные и положительные пластины монтируются в блоки, расположенные в сосуде с электролитом так, чтобы в промежутки между отрицательными пластинами входили положительные пластины, число которых на одну пластину меньше числа отрицательных пластин. Для предохранения пластин от замыкания между ними помещены изолирующие прокладки. Номинальное напряжение единичного кислотного аккумулятора равно 2.0 В, при зарядке напряжение на аккумуляторе доводится до 2.6 - 2.8 В, в начале разрядки быстро снижается до 2.2 В, разряжать аккумулятор ниже 1.9 В не допускается.
На предприятиях и сооружениях связи должны применяться стационарные кислотные закрытые аккумуляторы типа СН. Допускается до замены применение открытых аккумуляторов типа С и СК. В отдельных случаях применяются также стартерные кислотные аккумуляторы. Аккумуляторы С и СК имеют емкость 36 - 5328 А*ч. Номинальная емкость аккумулятора указывается в условном обозначении числом, стоящим после букв С и СК. Значение номинальной емкости соответствует результату умножения индексового номера на 36. Например, аккумулятор СК148 обладает номинальной емкостью С10= 148*36 = 5328 А*ч.
Индексовый номер N аккумуляторов типа С и СК каждой группы резервной батареи представляет собой ближайшее большее целое число, определяемое выражением 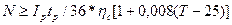 , где IР -максимальное значение разрядного тока, A; tp - установленное время разряда; ηp = Ср/С10 - коэффициент изменения емкости аккумулятора; Т -температура электролита, °С; 0.008 - температурный коэффициент емкости аккумулятора, 1/°С; 25 - номинальная температура электролита, °С.
, где IР -максимальное значение разрядного тока, A; tp - установленное время разряда; ηp = Ср/С10 - коэффициент изменения емкости аккумулятора; Т -температура электролита, °С; 0.008 - температурный коэффициент емкости аккумулятора, 1/°С; 25 - номинальная температура электролита, °С.
В настоящее время на предприятиях связи применяется в основном один способ эксплуатации батарей, составленных из аккумуляторов типов С и СК - непрерывный подзаряд. При этом способе эксплуатации в нормальном режиме работы ЭПУ (при наличии сети переменного тока), аппаратура питается от выпрямительных устройств. Полностью заряженная аккумуляторная батарея подключена параллельно нагрузке и получает непрерывный подзаряд (для компенсации саморазряда) от этих устройств.
Эксплуатация аккумуляторных батарей в режиме заряд - разряд практически не применяется (допускается в виде исключения только при малой мощности ЭПУ). Недостатки: малый срок службы аккумулятора (6-7 лет), низкий КПД электропитающей установки в целом, большие габариты и масса батарей. Этот способ эксплуатации предусматривает наличие двух батарей. Когда одна из них разряжается на нагрузку, то вторая заряжается или заряженная находится в резерве.
Эксплуатация аккумуляторных батарей в режиме непрерывного подзаряда характеризуется следующими положительными качествами: высокая надежность ЭПУ, так как положительно заряженная батарея постоянно подключена параллельно нагрузке, высокий КПД электропитающей установки, практически равный КПД буферного ВУ, поскольку затраты мощности на подзаряд батареи относительно малы.
Ток поздаряда 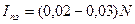 (A). Большой срок службы аккумуляторов (не менее 20 лет); сравнительно малая емкость аккумуляторных батарей, обеспечивающая аварийное питание нагрузок в течение времени, определяемого условиями электроснабжения и принятой системой электропитания (не более трех часов).
(A). Большой срок службы аккумуляторов (не менее 20 лет); сравнительно малая емкость аккумуляторных батарей, обеспечивающая аварийное питание нагрузок в течение времени, определяемого условиями электроснабжения и принятой системой электропитания (не более трех часов).
Для компенсации саморазряда и содержания батареи в полностью заряженном состоянии необходимо на батареях поддерживать напряжение из расчета 2.2 ± 0.05 В на аккумулятор. Поскольку в конце разряда напряжение снижается до 1.8 В (ввиду малой емкости аккумулятора), то для поддержания напряжения в пределах, обеспечивающих нормальную работу аппаратуры, батарея выполняется секционированной. В нормальном режиме параллельно нагрузке подключается основная группа аккумуляторов, а дополнительные получают подзаряд от вспомогательных маломощных выпрямительных устройств. В аварийном режиме по мере разряда аккумулятора основной группы последовательно к ним подключаются аккумуляторы дополнительных групп, что дает возможность поддерживать необходимое напряжение на нагрузке.
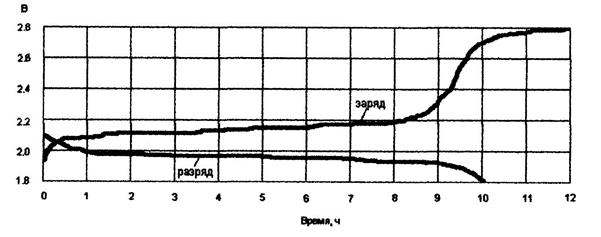
Предельное напряжение, до которого можно разряжать аккумулятор стационарного типа, составляет 1.8 В для режимов разряда не короче одночасового и 1.75 В для более коротких режимов разряда. Дальнейший разряд приводит к образованию крупнокристаллического сернокислого свинца на пластинах, что исключает возможность последующего нормального эксплуатационного заряда аккумулятора.
При заряде кислотного аккумулятора неизменным по величине током, напряжения его сравнительно быстро возрастает до 2.1 – 2.15 В. Затем, медленно повышается до напряжения 2.2 – 2.3 В по мере восстановления активной массы пластин и повышения плотности электролита. При напряжении выше 2.4 В начинается бурное выделение водорода и кислорода, приводящее к разрушению пластин.
Дата добавления: 2021-01-11; просмотров: 274;










