Свойства краун-эфиров
Краун-соединения
Краун-соединения (краун-эфиры) – макроциклы, содержащие в своем составе наряду с метиловыми звеньями (–СН2–СН2–) кислородные атомы, в некоторых случаях часть атомов О заменена атомами N или S. Открытие и синтез краун-эфиров – одна из наиболее ярких страниц в развитии органической химии 20 века. Первый из этого класса макроциклических соединений – дибензо-18-краун-6 – был получен Чарлзом Джоном Педерсеном (США) в 1967 г. (За открытие нового класса соединений он был удостоен Нобелевской премии по химии в 1987г.) Педерсен изучал свойства различных стабилизаторов каучуков, нефтяных масел, резиновых материалов. Основное назначение этих стабилизаторов заключалось в предотвращении разрушения антиоксидантов, которое инициировалось присутствием следовых количеств металлов.
Он синтезировал соединение, названное им краун-эфиром за особенность его структуры: она представляла собой пустое внутри и подвижное кольцо из 12 углеродных атомов, связанное через мостики 6 кислородными атомами. Все атомы кислорода как бы выведены из плоскости цикла и ориентированы в одну сторону, что очень облегчает их последующее полярное взаимодействие с катионом металла.
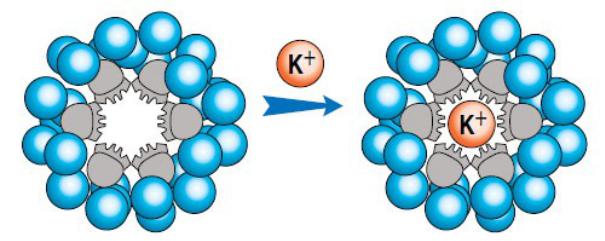
Обратив внимание на удивительную способность этих макроциклов заключать в свою полость катионы металлов – "короновать" их, Педерсен и предложил соответствующее название этому новому классу веществ – краун - соединения (от англ. crown – корона)
Существует множество методов синтеза краун - соединений, однако наиболее важный аспект любого из них заключается в подавлении побочных реакций, приводящих к линейным полимерам, для преимущественного протекания реакции циклизации, приводящей к циклическим соединениям.
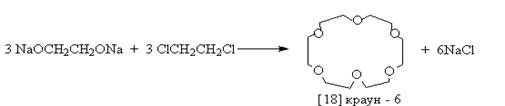
Обычно для синтеза краун - соединений используют реакцию Вильямсона:
или галогенов b,--b ' - дигалогеналкиловых эфиров.
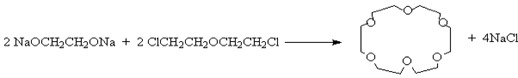
Для подавления образования побочных линейных полимеров часто применяются следующие методы: способ высокого разбавления, двухстадийная конденсация, матричные реакции.
Ароматические краун-эфирыпредставляют собой циклический олигомер алкиленоксида, в структуру которого включены одно или несколько ароматических колец. Типичными ароматическими краун-эфирами являются бензо- и дибензозамещенные краун-эфиры, включая дибензо-18-краун-6.
Основным методом синтеза ароматических краун-эфиров, является реакция Вильямсона, согласно которой в качестве исходных реагентов использовались пирокатехин и дихлордиэтиловый эфир.
Ароматические краун-эфиры, плохо растворимы в воде, спиртах и обычных растворителях при комнатной температуре, но легко растворимы в хлористом метилене, хлороформе, пиридине и муравьиной кислоте. Хотя ароматические краун-эфиры сами по себе обладают незначительной растворимостью, она, как правило, возрастает при образовании комплексов краун-эфиров с неорганическими солями. Это одно из наиболее важных свойств краун-соединений. Ароматические краун-соединения в целом устойчивы к нагреванию.
Алициклические краун-эфиры, содержат одно или более насыщенных алифатических колец, например, дициклогексил-18-краун-6.
Алициклические краун-эфиры легко ратворяются в органических полярных, малополярных или неполярных растворителях, такие, как ароматические и алифатические углеводороды. В воде при повышении температуры растворимость понижается.
Краун-соединения со смешанными донорными атомами (азакраун-эфиры и тиакраун-эфиры).
Азакраун-эфиры получают: 1) ацилированием ди- или полиаминов с частично защищенными аминогруппами хлорангидридами дикарбоновых кислот в условиях большого разбавления с последующим восстановлением образующихся макроциклических диамидов:

2) алкилированием дитозилдиаминов дигалогенопроизводными или дитозилатами гликолей в присутствии гидридов или гидроксидов щелочных металлов, а также в условиях межфазного катализа, н-р:

Тиакраун-эфиры получают из тиааналогов полиэтиленгликолей аналогично обычным краун-эфирам или алкилированием дитиолов дигалогенидами или дитозилатами в присутствии оснований.
Свойства краун-эфиров
Краун-эфиры содержат фрагмент С-О-С, характерный для простых эфиров, а также могут включать фрагменты амина C-NH-C, или тиоэфира C-S-C. Характерное свойство этих классов соединений - образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла. В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы.
Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 наиболее прочно захватывает катион лития, 15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 "подходит по размеру" катиону калия.
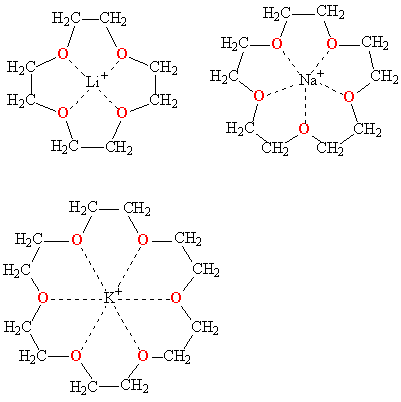
Комплексы краун-эфиров с катионами щелочных металлов (пунктирными линиями показаны координационные связи)
У краун-эфиров склонность к "захвату" катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживается. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда (рис.А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис.Б).

Варианты объединения краун-эфиров с катионами различного размера. А - две молекулы 12-краун-4 в комплексе с К+. Б - два катиона Na+ в полости молекулы 24-краун-8.
Подобные комплексы менее устойчивы, чем те, у которых размер катиона точно соответствует величине внутренней полости.
Краун-эфиры открыли новые горизонты в синтетической органической химии, с их помощью оказалось возможным вводить в растворенном виде (т.е. гомогенно), неорганические реагенты в органическую среду. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Появление краун-эфиров заметно расширило возможности экспериментальной химии. Стало возможным переводить в органическую среду типичные неорганические соединения и проводить с ними различные реакции.
Дата добавления: 2020-12-11; просмотров: 474;










