Комплексы «включения» циклодекстринов
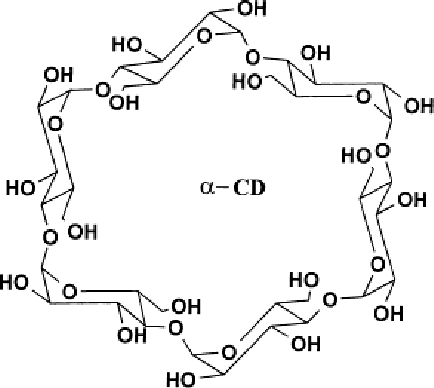
Циклодекстрины (ЦД) – природные циклические олигосахариды, построены из определённого числа D-глюкопиранозных звеньев, связанных между собой α-1,4-глюкозидной связью (рис. 1).
а б
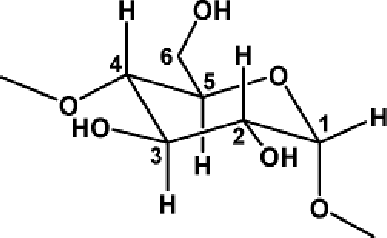
Рис. 1. Структура a-циклодекстрина (а) и нумерация атомов в глюкопиранозном фрагменте (б)
Внимание исследователей к данному типу соединений связано с тем, что ЦД способны образовывать прочные комплексы с широким кругом неорганических солей и органических молекул. В настоящее время ЦД различного размера и модификации выпускают в ряде стран мира, в том числе и в России.
ЦД получают путем расщепления крахмала ферментом амилазой либо криолизом водных растворов крахмала. Наиболее распространёнными являются a- (6 глюкопиранозных звеньев), b- (7 глюкопиранозных звеньев) и g-циклодекстрины (8 глюкопиранозных звеньев).
Строение ЦД определено с использованием совокупности физико- химических методов. Установлено, что все глюкопиранозные звенья имеют конформацию кресла (рис.1б).
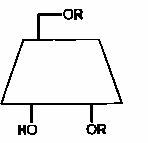
Следствием такой конформации является то, что все гидроксильные группы у С-6 направлены в одну сторону, а гидроксильные группы у С-2 и С-3 – в другую. При таком расположении гидроксильных групп создаётся возможность образования водородных связей, что придаёт жёсткость структуре ЦД. Структура ЦД напоминает усечённый конус, по нижнему и верхнему ободу которого расположены гидроксильные группы (рис. 2).
 Гидрофобная полость Гидрофильная оболочка
Гидрофобная полость Гидрофильная оболочка
Рис. 2. Структура циклодекстрина
Внутри конуса гидроксильных групп нет, поэтому внутренняя полость является гидрофобной, а внешняя оболочка – гидрофильной. ЦД хорошо растворим в воде, внутри полости ЦД могут разместиться гидрофобные молекулы. Таким образом, ЦД может капсулировать гидрофобные молекулы и переносить их в водный раствор.
Циклодекстрины плохо растворимы в органических растворителях, устойчивы в щелочных растворах, но гидролизуются в кислой среде. В табл.1 представлены некоторые физико-химические характеристики ЦД.
Таблица 1. Физико-химические характеристики ЦД
| Характеристики | α-ЦД | β-ЦД | γ-ЦД |
| Молекулярный вес | 972,85 | 1134,99 | 1297,14 |
| Внешний диаметр, Å | 13,7 | 15,3 | 16,9 |
| Внутренний диаметр, Å | 5,2 | 6,6 | 8,4 |
| Высота, Å | 7,8 | 7,8 | 7,8 |
| Растворимость в воде при 25 °С, г/100 мл | 14,5 | 1,85 | 23,2 |
| Температура разложения, °С |
Поскольку ЦД имеют симметричное строение, в ЯМР-спектре ЦД все глюкопиранозные звенья имеют одинаковые химические сдвиги протонов. На положение сигналов протонов ЦД оказывает существенное влияние природа растворителя.
Большое внимание исследователей привлекают модифицированные ЦД. Реакции модификации гидроксильных групп традиционны для олигосахаридов. Основной трудностью при синтезе является образование производных ЦД с различной степенью замещения гидроксильных групп. Для выделения индивидуальных соединений успешно используется препаративная жидкостная хроматография.
Процессы комплексообразования ЦД весьма разнообразны. Так, с участием гидроксильных групп возможна координация органических и неорганических катионов, в то время как незаряженные органические молекулы могут располагаться внутри полости ЦД (рис.3).
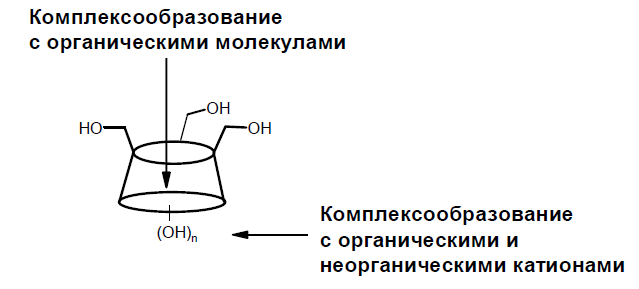
Рис.3. Схема комплексообразования циклодекстринов
На рис. 4 представлены константы устойчивости комплексов замещённых нитрофенолов с a-ЦД.
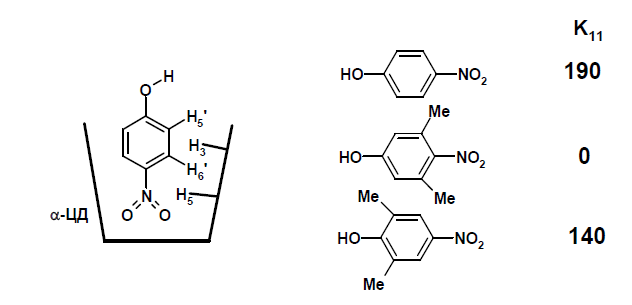
Рис.4. Структура и константы комплексообразования a-ЦД с производными нитрофенола
Молекула нитрофенола может образовывать комплекс, погружая в полость a-ЦД либо нитрогруппу, либо гидроксильную группу (как видно из рис. 4). Нитрофенол, имеющий метильные группы в 3,5-положениях бензольного ядра, т.е. в непосредственной близости к нитрогруппе, не образует комплекса с a-ЦД. В случае нитрофенола с расположением метильных групп в 2,6-положениях бензольного ядра вблизи гидроксильной группы обнаружено образование комплекса с константой утойчивостью немного ниже той, что обнаружена для нитрофенола. Это означает, что объёмные заместители вблизи нитрогруппы препятствуют вхождению молекулы в полость циклодекстрина. Следовательно, в комплексе расположение нитрофенола в a-ЦД таково, что нитрогруппа погружена в a- ЦД, а гидрокильная группа располагается на уровне верхнего обода a-ЦД. Дополнительным доказательством структуры комплекса являются данные ЯМР-спектроскопии. В двумерных ЯМР-спектрах обнаружены кросс-пики Н-6¢(нитрофенол) « H-5 (ЦД) и Н-5¢(нитрофенол) « H-3(ЦД) (рис. 4).
На рис. 5 показаны структуры комплексов a-ЦД с коричной кислотой. Результаты исследования показали, что комплекс, в котором a-ЦД располагается на двойной С=С связи, имеет более высокую устойчивость (К11) по сравнению с комплексом, когда a-ЦД включает в свою полость ароматический фрагмент (К12).

 O O
O O
OH OH
K11 K12
Рис. 5. Структуры комплексов a-ЦД с коричной кислотой
Комплексообразование органических молекул с ЦД используется для модификации характеристик молекул-«гостей». Так, был получен краунсодержащий 2-стирилбензотиазол, имеющий свойства оптического сенсора на катионы металлов. Координация катионов металлов по краун- фрагменту приводит к изменению флуоресценции лиганда. Следует отметить, что растворимость данного лиганда в воде низка, что препятствует его использованию для ионного анализа в воде. С b-ЦД краунсодержащий 2-стирилбензотиазол образует комплекс-«включения», который имеет высокую растворимость в воде (рис.6). Оказалось также, что комплекс имеет более яркие флуоресцентные характеристики. Таким образом, капсулирование флуоресцентного лиганда молекулой b-ЦД приводит к образованию нового супрамолекулярного лиганда для катионов металла со свойствами, улучшенными по отношению к исходному молекулярному сенсору.
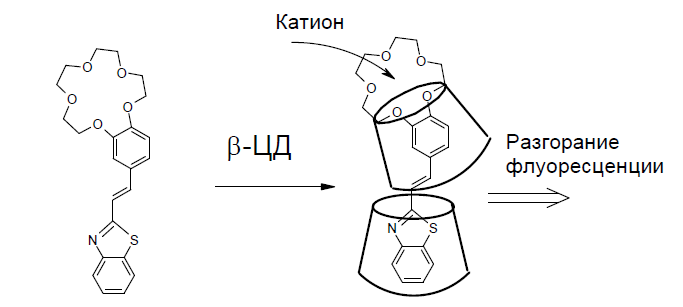
Рис. 6. Комплекс b-ЦД с краунсодержащим 2-стирилбензотиазолом
Комплексообразование ЦД с катионами металлов аналогично по механизму комплексообразования каликсаренов: наблюдается замещение протона в гидроксильной группе на катион металла. Для облегчения отрыва протона реакцию проводят в присутствии оснований.
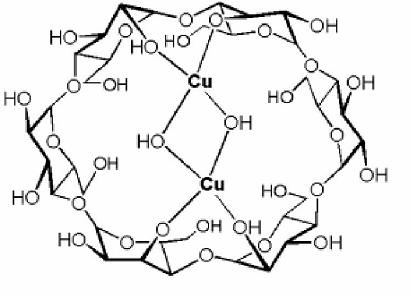
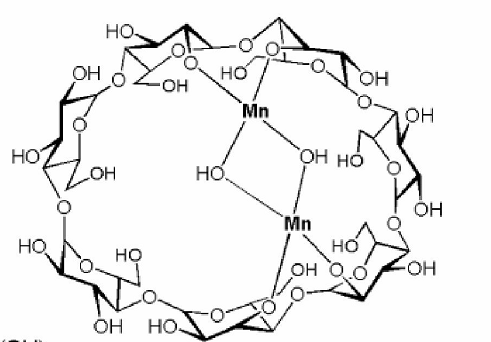
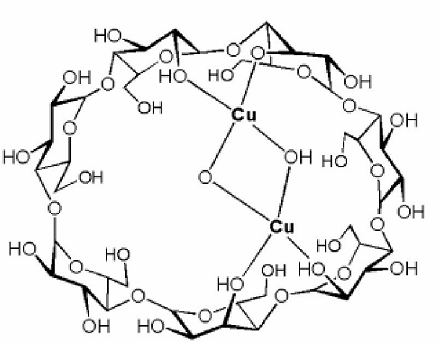
Было показано (рис. 7), что медь координируется по двум противоположным гидроксильным группам молекулы, а положение координации меняется при изменении размера ЦД. Аналогичный комплекс образует и марганец.
Рис. 7. Комплексообразование циклодекстринов с солями металлов
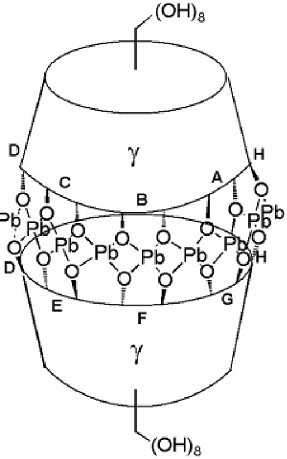
В присутствии катионов свинца наблюдается димеризация ЦД. Свинец как бы по кругу сшивает две молекулы ЦД. Следует отметить, что комплексообразование происходит с участием гидроксильных групп при вторичных атомах углерода.
На рис. 8 приведен пример двухточечного комплексообразования. Если в качестве «шапочки» у ЦД используется заместитель, включающий азотсодержащий гетероцикл, то катионы меди координируются прежде всего с таким гетероароматическим фрагментом. Органический фрагмент медной соли погружается в полость ЦД за счёт гидрофобного взаимодействия его с ЦД. В результате осуществляется двухточечное связывание органической соли меди с ЦД.
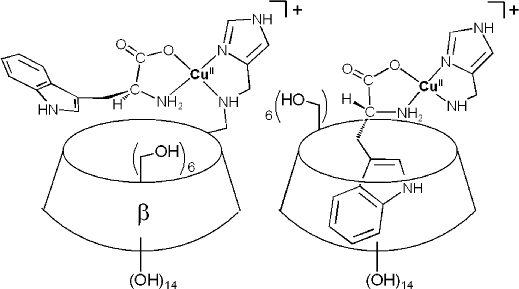
Рис. 8. Двухточечное комплексообразование циклодекстрина с солями меди
В литературе описаны многочисленные примеры по синтезу полимерных циклодекстринов. Для осуществления синтеза полимерного ЦД на первом этапе получают его комплекс с мономерным фрагментом, а затем проводят полимеризацию закомплексованных мономеров. В конце процесса добавляют реагенты, присоединение которых прекращает полимеризацию. Если вводимые терминальные группы имеют большой размер, то они являются стопором для предотвращения соскальзывания ЦД с полимерной цепи (рис.9).
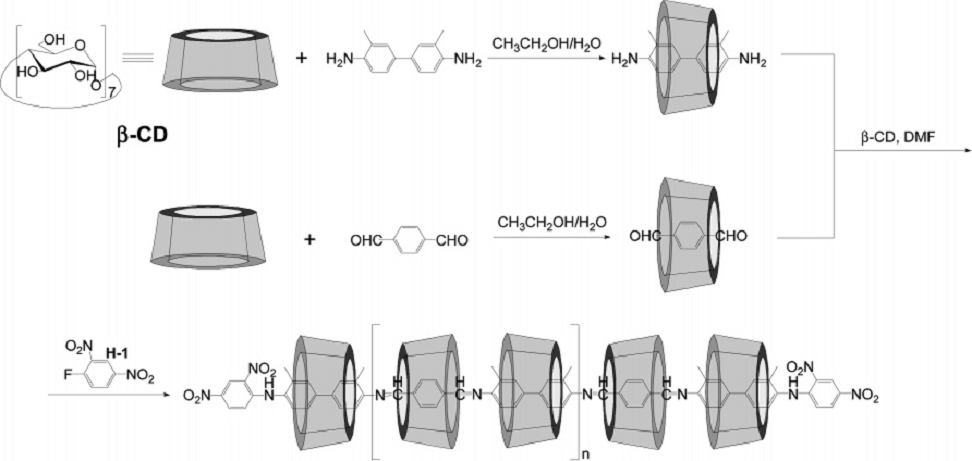
Рис. 9. Пример синтеза полимерного ЦД
Полимеры такого типа могут использоваться для создания на их основе различных современных материалов.
Одним из основных применений ЦД является его использование в качестве реакционного контейнера. Например, было показано, что ЦД способны образовывать комплексы с 4-стирилпиридином (рис. 10).
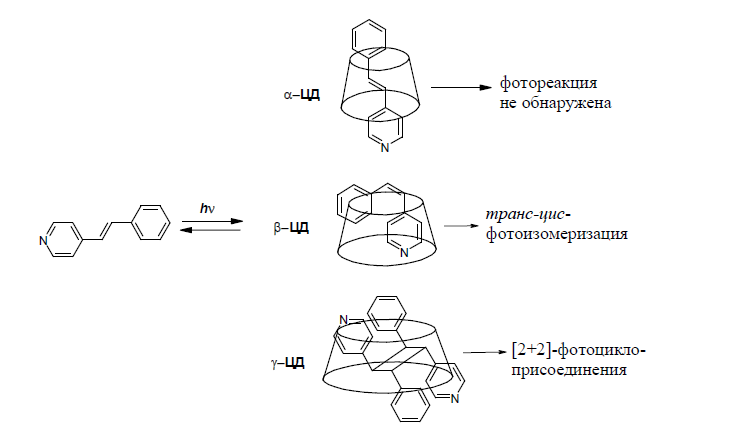
Рис.10. Примеры фотохимических реакций в полости циклодекстрина
Облучение этих комплексов ведёт к протеканию фотохимических процессов, зависящих от размера полости ЦД. Так, комплекс 4-стирилпиридина с a-ЦД остаётся инертным к облучению светом. Видимо, в ограниченном пространстве a-ЦД конформационные перестройки молекулы, сопровождающие фотореакции, невозможны. В комплексе с b- ЦД наблюдается протекание обратимой реакции тран-цис-изомеризации. В комплексе с g-ЦД была обнаружена реакция [2+2]-циклоприсоединения, поскольку размер полости g-ЦД позволяет разместиться в ней двум молекулам гетеростильбена с образованием димера с ориентаций молекул «голова-к-хвосту» (рис. 10).
Капсулирование органических молекул ЦД приводит к модификации их реакционной способности. В табл. 2 приведены примеры влияния капсулирования на протекание различных химических реакций.
Таблица 2. Изменение скоростей ряда реакций в присутствии ЦД
| Реакции | Субстрат | Ускорение, раз |
| Гидролиз эфиров | Фениловые эфиры | |
| Гидролиз амидов | Пенициллины | |
| Расщепление фосфатов | Диарилметилфосфаты | |
| Декарбоксилирование | Цианоацетаты | |
| Реакции Дильса-Альдера | Циклопентадиен+бутен |
Следует отметить, что реакционная способность молекул в полости ЦД не коррелирует с прочностью комплекса. Наиболее важным моментом является наиболее выгодная пространственная ориентация субстрата по отношению к реакционному центру или реагирующим группам для эффективного их взаимодействия.
По данным международной Ассоциации в настоящее время циклодекстрины находят применение в следующих областях:
- Защита материалов от окисления и старения под воздействием УФ- излучения в течение срока хранения или использования.
- Стабилизация ароматизаторов и специй.
- Маскировка горечи и неприятного запаха пищевых продуктов, лекарств и косметических средств.
-Преобразование жидких материалов в сухие формы.
-Улучшение растворимости веществ с низкой растворимостью в воде.
-Эмульгирование гидрокарбонов, стероидов, жиров и жирных кислот.
-Управляемое действие активных компонентов лекарств и ароматизаторов.
-В качестве катализаторов химических реакций.
-Искусственная среда химического синтеза.
ЦЕОЛИТЫ
Название происходит от шведского минералога и химика Акселя Фредрика Кронштедта, который обнаружил никель в 1751 году. Он придумал термин «цеолит» после нагревания минералов с помощью пламени, что означает от греческого слова «zeo» (кипятить) и «líthos» (камень).
Цеолиты взаимодействуют с водой, выделяя большое количество газов с пузырьками, а при нагревании очень долго выделяется водяной пар.



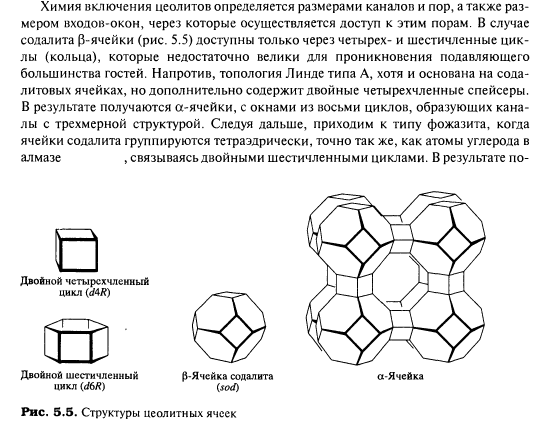

Сотовая структура цеолитов позволяет им поглощать большое количество молекул газа, влаги и многих химических веществ.
В качестве сушильного агента превосходит другие популярные варианты, такие как силикат алюминия и силикат кальция. Это делает его отличным выбором для дезодорации и осушения влажных темных помещений, например, подвалов.
В дополнение к поглощению избытка воды и плесени, цеолит доказал свою эффективность против тяжелых металлов и других веществ, таких как:
· Радиоактивные газы;
· Бактериальные запахи;
· Формальдегид;
· Диоксид серы;
· Свинец;
· Аммиак.
Вот почему его используют в чрезвычайных ситуациях загрязнения, разливах нефти и ядерных авариях (например, Три-Майл-Айленд и Чернобыль).
Дата добавления: 2020-12-11; просмотров: 704;










