Защита металлов от коррозии.
Металлы, как и растения, животные и люди тоже «болеют». Это не только износ рабочих поверхностей и деформации (температурные и нагрузочные) деталей, но и самая опасная «болезнь» строительных и машиностроительных конструкций- коррозия металлов. Общеизвестен закон природы : из двух состояний с большей вероятностью реализуется то, которое более устойчиво (стабильно). Металлы в природе находятся в виде химических соединений с кислородом , серой и другими химическими элементами ( Fe3O4, Fe2O3, FeO, Al2O3, ...). Мы извлекаем технически чистый металл из этих окислов, далее получаем сплавы металла, из которых изготовляем различные детали, машины и сооружения, а природа путем коррозии металлических изделий вновь небезуспешно возвращает все на круги своя – к окислам и другим природным химическим соединениям.
За всю историю человечества добыто около 20 млрд тн железа, около 6 млрд тн его находится сейчас в машинах и строительных конструкциях, а 14 млрд тн уже съедено ржавчиной, т.е. утеряно для человека. На ремонт корродированных машин и строительных конструкций, на замену труб водопровода, отопления, на антикоррозийную защиту и профилактику коррозии затрачивается много времени и труда. В итоге около 30 % ежегодно производимого металла расходуется на восстановление потерь от коррозии.
Есть два вида коррозии : химическая и электрохимическая.
 |
Процесс коррозии определяется тремя видами факторов (рис.1.45): химической природой и структурой металла или сплава, из которого изготовлена деталь ; содержанием агрессивных веществ в окружающей среде и температурой среды.
Химическая коррозия — это разрушение металлов под воздействием высокотемпературных газов или жидкостей (без электролиза). При высоких температурах образуется нагар на клапанах и головках блока цилиндров, на свечах зажигания, на поршнях (верхней части юбки и поршневых канавках), на компрессионных кольцах, на арматуре печей и на тепло- и электронагревателях. Сначала на поверхностях деталей при температурах до 150 °С образуются лаковые покрытия, далее при более высоких температурах появляется нагар.
Электрохимическая коррозия проходит в жидких средах, проводящих электрический ток; в процессе ее происходит электролитическое разрушение металла.
Одним из условий для возникновения электрохимической коррозии является наличие воды. Вода есть в атмосфере, в грунте, на поверхностях деталей и конструкций. В почве, воздухе и рабочих средах также имеются окислы и кристаллы солей, сернистые и выхлопные газы и , в итоге, образуются кислоты –это второе условие появления коррозии.
 |
Рассмотрим процесс коррозии ( рис.1.46) на примере наличия в изделии разных металлов: меди и цинка. В кислой среде атомы цинка оставляют свои электроны на аноде и превращаются в положительно заряженные ионы цинка и переходят в жидкость, а на катоде (пластине меди) анионы водорода получают электроны , поэтому на катоде будут выделятся атомы водорода из раствора.
Исходя из вышеизложенного, для возникновения процесса электрохимической коррозии необходимы три условия:
-наличие воды;
- наличие солей, кислот;
- наличие разных металлов, т. е. металлов. или отдельных его фаз с отличающимся водородным потенциалом.
Гальванические пары образуются на только между различными материалами, но и между микроскопическими малыми различными кристаллами сплава. Иногда субмикроскопические гальванические пары могут происходить по границам зерен. Например, высокохромистые стали подвержены межкристаллической коррозии. Фазы с хромом имеют положительный потенциал, а обедненные хромом — отрицательный (Fe). Внешне никаких изменений о сплавом не происходит, а свойства его ухудшаются, что очень опасно при работе изделия.

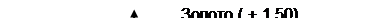 Атомы металлов при контакте с электролитом переходят в раствор в виде ионов. Переход атомов металлов в ионы, т.е. растворение металлов определяется величиной нормального электродного потенциала (рис. 1.47 ), который представляет собой величину напряжения (В) электрического .тока, которое нужно приложить к границе раздела фаз металл — жидкость, чтобы воспрепятствовать переходу иона металла в раствор. Чем больше отрицательное значение потенциала ( - ), тем металл больше стремится к растворению в электролитах., тем интенсивнее идет коррозия.
Атомы металлов при контакте с электролитом переходят в раствор в виде ионов. Переход атомов металлов в ионы, т.е. растворение металлов определяется величиной нормального электродного потенциала (рис. 1.47 ), который представляет собой величину напряжения (В) электрического .тока, которое нужно приложить к границе раздела фаз металл — жидкость, чтобы воспрепятствовать переходу иона металла в раствор. Чем больше отрицательное значение потенциала ( - ), тем металл больше стремится к растворению в электролитах., тем интенсивнее идет коррозия.
Металлы с отрицательным водородным потенциалом ( - ) вытесняют водород из кислот, а металлы с положительным потенциалом( + ) -вытесняются водородом из раствора.
В случае толстой плотной пленки возможна стабилизация коррозии. Такие пленки образуются на алюминии, свинце, олове, никеле и хроме. Они не пропускают газы к поверхности детали. На железе тоже создаются плотные пленки, но они растрескиваются и поэтому отслаиваются от железа. Техническое железо ржавеет при обычных температурах, при более же высоких температурах (250… 300 °С) пленка ржавчины образуется прямо на глазах, а при 600 °С поверхность железа очень быстро покрывается толстым слоем окалины. Из-за того, что пленка пористая, газы хорошо проникают к поверхности металла и скорость коррозии не снижается, т.к. нет защитного эффекта от пленки.
 |
Коррозионные разрушения (рис.1.48.) могут быть сплошными (равномерными и неравномерными), местными ( пятнами и точками ) и межкристаллическими .
Из рисунка 1.49 видно, что уменьшение коррозии возможно при реализации следующих мероприятий :
подбора материала детали ;
снижение агрессивности среды ;
создание защитных пленок и управление процессом коррозии.
Методы защиты от коррозии (рис. 1.49) определяются необходимостью нейтрализации факторов (рис. 1.45) , определяющих интенсивность коррозии: подбор антикоррозийных материалов ; снижение агрессивности и температуры среды; отделение поверхности детали от агрессивной среды; целевое управление процессом коррозии.
1.Подбор материала детали выполняется исходя из водородного потенциала металла. Так из рис. 1. 46 видно, что изделия из золота , платины и серебра более корозийностойкие, чем изделия из железа, цинка и алюминия, но эти материалы дорогие, поэтому находят ограниченное применение в быту и технике. Химически чистые металлы имеют более высокие антикоррозионные свойства, чем сплавы , так «демидовское железо», выплавляемое на древесном угле из хороших руд, практически не ржавеет, а современный листовой прокат нельзя использовать без защитных покрытий. В противовес использованию химически чистых металлов добавки некоторых легирующих элементов , в основном в больших количествах Cr и Ni , позволяют получить так называемые нержавеющие стали (12Х18Н10Т, 12Х18 Н9, 08Х22Н6Т,… ).

Чугуны коррозийно более стойки чем стали, а у последних скорость коррозии увеличивается с ростом содержания углерода. Алюминий и его сплавы имеют очень низкий водородный потенциал, но на поверхности детали относительно быстро образуются прочные и стойкие защитные пленки, поэтому алюминиевые детали не требуют дополнительной защиты ( покраски и др.) от коррозии.
2. Снижение агрессивности среды выполняется путем добавки антиокислительных присадок в смазочное масло и топливо и в системы охлаждения. Для систем отопления проводится предварительная подготовка воды ( удаление солей и железа). Немаловажным фактором является снижение температуры теплоносителя, например, для систем отопления со 100…110 оС до 60…70 оС, что , естественно , приведет не только к снижению тепловых потерь, но и к уменьшению коррозии элементов системы.
3. Покрытия поверхностей деталей могут выполнять следующие задачи: отделение материала детали от агрессивной среды; замыкание гальванической электрической цепи не через агрессивную среду, а через металлическое покрытие, и , в результате , прекращение электрохимической коррозии; «жертвование» материала покрытия ( в основном Zn) на коррозионное разрушение и тем самым снижение коррозии основного материала детали.
Покрытия наносятся на поверхности деталей (хром и никель), посуду (эмаль), жесть и трубы (цинк), консервные банки и днища (лужение кузовов) легковых автомобилей, например, автомобилей М20 «Победа» . В настоящее время для изготовление днищ кузовов используются неметаллические и биметаллические покрытия.
Металл наносят с помощью электрогальванических процессов (осаждение никеля, хрома, цинка) или металлизации. Гальваническое покрытие обеспечивает хорошее сцепление с основным металлом , но требует технологически сложной подготовки поверхностей и высокой культуры производства.
4.
 |
Метод защиты металлов протекторами (рис. 1.50) заключается в том ,что к трубопроводу подключают через кабель пластины металла, имеющего более низкий водородный потенциал , который ,естественно , растворяется и разрушается в первую очередь, защищая основное изделие от коррозии.
 |
5. Способ катодной защиты внешним током (рис. 1.51 ) металлических конструкций, судов и магистральных трубопроводов впервые был применен в 1910 году для защиты от коррозии подземных строительных сооружений. Этот способ отличается от метода протекторов тем, что к защищаемой детали подводится отрицательный потенциал от источника питания, а положительный- к вспомогательному аноду. В случае «естественной» коррозии деталь « теряет » электроны, а так как здесь , наоборот, электроны подводятся к детали, то и не происходит процесса ее коррозии.
Одной из основных технологических операций защиты деталей строительных конструкций и машин от коррозии является окраска (рис. 1.52) ,предназначенная не только для защиты от коррозии, но и для эстетических целей.
 |
Подготовка поверхности к окраске заключается в механической правке и выравнивании поверхностей, обезжиривании поверхности перед окраской и фосфатировании. Обезжиривание выполняется растворителями , бензином или погружением узла в ванну с раствором кальцинированной (реже каустической) соды, жидкого стекла и тринатрийфосфата. После обезжиривания промывают деталь (узел) горячей водой.
Фосфатирование поверхности получается при обработке деталей фосфорной кислотой или раствором солей, или фосфатирующим грунтом .Фосфатный слой хорошо защищает поверхность от коррозии, причем в случае его повреждения и слоя краски коррозия не будет распространятся от места повреждения под неповрежденной частью..
Грунтовка необходима для обеспечения хорошей сцепляемости металла с краской или шпаклевкой и для предохранения металла от коррозии. После нанесения грунтовки краскораспылителем или кистью производится сушка покрытия при температуре 80 …100 °С в течение 40 минут или при 18 … 25° С до 48 часов.
Шпаклевание поверхности необходимо для выравнивания поверхности от рисок, царапин, дефектов сварных швов, а также для защиты металла от коррозии. Шпаклевки снижает механическую прочность покрытия, поэтому рациональна минимально необходимая их толщина. При необходимости заделки больших дефектов используются эпоксидные шпаклевки , которые можно наносит слоем до 20 мм.
Шпаклевание может быть местное и сплошное. Сначала выполняется местное шпаклевание, с помощью шпателя вручную выполняют замазку трещин, швов и раковин. Сплошное шпаклевание выполняется с помощью краскораспылителя. Просушка выполняется без подогрева в течении 30 минут. Шлифование слоя шпаклевки проводится шлифовальными шкурками вручную или шлифовальными машинками.
Наружные слои покрытия предназначены для декоративных и защитных целей. В зависимости от необходимости высококачественной декоративной покраски или обыкновенной выбирается краска, количество и качество технологических операций.
 |
Для окраски используются нитроэмали и синтетические эмали. Достоинством нитроэмалей является просушка при естественной температуре в течении 10… 15 минут. Всего наносится 5 …6 слоев толщиной 8 …10 мкм с обязательной просушкой каждого слоя. Однако нитроэмалевое покрытие имеет недостаточную стойкость к коррозии и требует сложной технологической полировки. Поверхность сначала шлифуется и покрывается растворителем, далее полируется пастами.
Синтетические эмали придают покрытию более устойчивый блеск и лучшую защиту от коррозии. Срок службы их 4 .. 5 лет. Количество слоев достаточно 2 …3 и значительно упрощается полировка. Однако полимеризация синтетического покрытия (просушка) происходит при высокой температуре 120 … 130° С в течение часа, что требует использования сложного оборудования.
Лакокрасочное покрытие может наноситься следующими способами :
1 - ручная окраска кистью;
2 - окраска погружением детали в ванну с краской;
3 - нанесение краски воздушным распылением;
4 - нанесение краски безвоздушным распылением;
5 - окраска в электростатическом поле (рис. 1.53) .
Воздушное распыление проводится с помощью пистолетов - распылителей в специальных камерах или помещениях, оборудованных вентиляционными установками. Краска подается под давлением сжатого воздуха или сил тяжести. Смешивание может выполнятся как внутри пистолета, так и снаружи. Наилучшие результаты получаются при наружном смешивании. Недостатками воздушного распыления являются : большие потери краски (до 40 …50 %), взрывоопасность лакокрасочного тумана, вредность для организма. В целях экономии растворителя, который нужен в основном для снижения вязкости краски, и который улетучивается при сушке, рационально для уменьшения вязкости краски её нагревать до 60 °С. При этом толщина одного слоя увеличивается в 1,5 … 2 раза по сравнению с окраской без подогрева, следовательно, необходимо меньше наносить слоев и поэтому увеличивается производительность окраски.
При безвоздушном распылении предварительно подогретая краска подается насосом под давлением 40… 60 кгс/ см2 через распылитель. При этом расход краски уменьшается 20 … 25 % по сравнению с воздушным распылением.
Наиболее эффективной технологией является окраска в электростатическом поле (рис. .1.53). Однако необходима предварительная окраска внутренних поверхностей и глубоких впадин. Кроме того, часть краски, не получив заряда, теряется. Почти 100 % использования краски получается при электромеханическом распылении, когда отрицательный заряд высокого напряжения сообщается не промежуточной среде (воздуху), а непосредственно краске.
Сушка покрытий заключается в удалении летучих веществ для нитроэмалей, а у синтетических эмалей и масляных покрытий после удаления летучих веществ происходит окисление и полимеризация связывающих веществ. Скорость сушки определяется температурой покрытия и степенью подвижности воздуха. При неподвижном воздухе пограничный слой воздуха насыщяется парами растворителя и дальнейший процесс испарения его замедляется.
 |
Различают по способу подачи тепла конвекционную и терморадиоционную сушки (рис. 1.54). В первом случае изделие обогревается горячим воздухом, при этом сначала очередь просушивается верхний слой, который замедляет дальнейшее испарения растворителя.
При терморадиоционной сушке источником тепла являются невидимые инфрокрасные лучи, которые свободно проходят через слой покрытия, нагревают металл. Испарение растворителя и образования корки начинается с нижней части слоя, тем самым создаются хорошие условия для отвода паров. Процесс полимеризации происходит тоже быстрее. Терморадиоционная сушка почти в два раза выполняется быстрее конвекционной сушки.
В качестве источников инфракрасного излучения применяются термоизлучатели, нагреваемые электрическим током или газом. Панели излучателей нагреваются до 400… 500 °С и излучают инфрокрасные лучи с длиной волны 3…5 мкм, которые легко проходят слой краски и , поглощаясь металлом, нагревают его .
«Полезность» ржавчины.
Прежде всего польза от коррозии- это возвращение на круги свои. Трубы, лист , швеллер и другой металл, зарытый в результате небрежной работы в землю, утопленный в болота и реки возвращается в свое естественное состояние- окислы (руда).
Архитектор Джон Динел в 1959 году в городе Молине создал «ржавое здание», считая что людям тошно смотреть на полированные алюминевые фасады и человечество должно вернутся к более грубому стилю. Институт американской архитектуры присудил «ржавому» зданию золотую медаль. В Чикаго построен небоскреб «Сивин сэнтер», покрывающийся потоками ржавчины во время дождя.
Мост через реку Консумнес через несколько месяцев после постройки приобрел красивую и редкую зеленовато - коричневую окраску (подобрана такая низкоуглеродистая сталь, которая покрывалась такой пленкой в атмосферных условиях).
Есть мостовые стали, которые ржавеют 2… 4 года, а потом образуется черная и плотная пленка, крепко сцепляющаяся с металлом и надежно защищающая его от дальнейшей коррозии.
Сварка металлов.
Сварка является одним из ведущих технологических процессов изготовления и упрочнения деталей , изготовления строительных конструкций, трубопроводов и судов, ремонта деталей и конструкций. Эффективно использование технологических приемов сварки и при резке металлов.
Исторически сварка известна человечеству со времен использования, меди, серебра, золота и , особенно, железа, при получении которого выполнялась проковка , т.е. сваривание криц (кусочков технически чистого железа) . Это и есть первый способ сварки -кузнечная сварка металла.
Наиболее распространена в производстве электродуговая сварка, являющаяся чисто российским изобретением. Впервые электрический дуговой разряд был выявлен петербургским профессором физики Петербургской медико-хирургической академии Петровым Василием Владимировичем в 1802 году, но только через 80 лет (1882 г.) российский инженер Бенардос Николай Николаевич, работая со свинцовыми аккумуляторными батареями, открыл способ сварки не плавящим угольным электродом. Он освоил технологию сварки свинцовых пластин. Далее он разработал способы сварки металла в среде защитного газа и электродуговой резки металла. Бенардос Н.Н. назвал свое изобретение «Электрогефест». По греческой мифологии Гефест — бог , покровитель кузнецов, поэтому в этом названии представлено новое –электричество и старое ( Гефест) , представляющее первый известный способ сварки (кузнечная сварка). Через 6 лет в 1888 году инженер Славянов Николай Гаврилович разработал способ сварки плавящим электродом.
Дальнейшую работу Славянов Н. Н. и Бенардос Н. Г. выполняли вместе. Внедрение сварки в производство проходило очень интенсивно, так в России с 1890 по 1892 года было по их технологии отремонтировано с высоким качеством 1631 изделие , общим весом свыше 17 тыс. пудов, это в основном чугунные и бронзовые детали. Они даже разработали проект ремонта российского памятника литейного производства «Царь-колокола», но работа не была разрешена , и мы сейчас можем любоваться на российские нетленные символы: колокол, который не звонил, и на пушку, которая не стреляла.
Известный мостостроитель академик Патон Евгений Оскарович, предвидя огромное будущее электросварки в мостостроении и в других отраслях хозяйства, резко сменил поле своей научной деятельности и в 1929 году организовал сначала лабораторию, а позднее первый в мире институт электросварки (г. Киев). Им было разработано и предложено много новых и эффективных технологических процессов электросварки. В годы войны в короткий срок под его руководством были разработаны технология и автоматические стенды для сварки под слоем флюса башен и корпусов танков. самоходных орудий , авиобомб.
  |
В настоящее время широкое развитие получили такие новые способы сварки как: порошковыми материалами, плазменная, контактная и электрошлаковая, сварка под водой и в космосе и др. , многие из которых были разработаны в Институте электросварки имени Е.О. Патона, который в последние годы возглавлял сын основателя института - академик Борис Евгеньевич Патон.
Кроме головного, в этой отрасли, института сварки имени Е.О. Патона, вопросами сварки успешно занимаются многие учебные институты (УПИ, ЧИМЭСХ, ЛГАУ и др.), институты объединения «Ремдеталь».
Преимущества использования сварки перед заклепочными и резьбовыми соединениями деталей при изготовлении строительных конструкций следующие:
-рациональность конструкций;
-экономия металла ( до 15…20 %);
-более высокая производительность (на 15...20 %).;
-более низкая себестоимость( снижение на 20...45 %);
-высокая надежность соединения.
2.1. Общие вопросы сварки.
Сваркой называется процесс получения неразъемного соединения деталей местным сплавлением или пластической деформацией. Наплавка — это разновидность сварки, заключающаяся в том, что на поверхность детали наносят слой металла, предназначенный для восстановления размеров изношенной детали или для повышения её износостойкости.















При восстановлении деталей сваркой и наплавкой можно получать долговечность их сопоставимой или даже более высокой с долговечностью новых деталей, использовать механизацию и автоматизацию процессов.
Сварка происходит при молекулярном или атомном взаимодействии металлов (рис. 2.1), для чего необходимо расплавление или пластическая деформация деталей. Расплавление металла происходит при температурах выше Тпл . При сварке плавлением расплавленный металл образует сварочную ванну,, при кристаллизации которой происходит соединение поверхностей.
При пластическом деформировании как предварительно нагретых так и холодных металлов разрушаются окисные пленки и поверхности сближаются до расстояний возникновения межатомных связей и поэтому происходит прочное соединение деталей. Из рис. 2.1. видно, что при увеличении температуры нагрева металла требуется меньшие усилия для сварки давлением.
В настоящее время известны сотни и сотни различных способов сварки в зависимости от вида энергии, особенностей технологического процесса, защиты от воздуха и др. Самая приближенная классификация видов сварки представлена на рис 2.2. Расплавление металла происходит за счет энергии дуги при электродуговой сварке и электрического тока, проходящего через расплавленный флюс при электрошлаковой сварке, бомбардировки в вакууме свариваемых поверхностей электронами, энергии от горения газов при газовой сварке, энергии от горения порошковой смеси при термитной сварке и расплавлением кромок деталей перегретым расплавленным присадочным металлом при литейной сварке.
 |
Виды сварных соединений различаются по взаимному положению деталей и по форме разделки сварного шва, а так же по положению сварного шва в пространстве (рис. 2.3).
Рис. 2.3. Виды сварных соединений ( h-толщина свариваемых деталей).
Дата добавления: 2020-11-18; просмотров: 298;










