Основы строения материалов.
По общей физической классификации материалы являются конденсированными системами, разделяющимися в порядке возрастания степени организации атомно-молекулярной структуры на ряд типов от жидкостей, стеклообразных и аморфных систем до кристаллических систем.
Наука о материалах, называемая материаловедением, изучает строение разнообразных материалов и закономерности их изменения путем регулирования химического состава, использования различных способов и технологий обработки, применения внешних электрофизических, радиоактивных и др. воздействий.
Строение материалов определяет их физико-механические, эксплутационные и другие разнообразные свойства.
В зависимости от назначения материалы в материаловедении подразделяются на следующие основные разновидности:
1. Конструкционные материалы с высокими механическими свойствами (прочностью, вязкостью, и др.) для изготовления машин, летательных аппаратов, судов, строительных конструкций и др. сооружений.
2. Инструментальные материалы в большинстве случаев с высокой твердостью и износостойкостью, применяемые при изготовлении металлорежущих, штамповых, измерительных инструментов, особенно в машиностроении.
3. Материалы с особыми физическими свойствами (магнитные, с высоким электросопротивлением, сверхпроводящие и др.) и функциональные материалы, обладающие специальными свойствами (антифрикционные, фильтровальные, фрикционные для тормозных устройств и др.)
Мировой объем производства основных металлических материалов составил к концу 20 века : сталь-800 млн. тонн/год, алюминий – 24 млн. тонн/год, медь – 12 млн. тонн/год, магний – 400 тыс. тонн/год, титан – 60 тыс. тонн/год. ( журнал « Металлург», 2002, №11).
Ниже рассмотрены основы строения различных видов материалов: металлических, пластических масс, каучуков и резиновых материалов, технической керамики, силикатного стекла и др.
1.1.Классификация структур материалов и методов их исследования.
При исследовании структуры материалов имеют в виду их внутреннее строение. От структуры зависят физико-механические свойства материалов. Исследования строения материалов проводят различными методами с использованием микроскопов разных видов, обеспечивающих увеличение в диапазоне от 100 до нескольких миллионов, рентгеноструктурного анализа и других методов. Применение более совершенной техники позволяет выявить новые детали структуры материалов.
Материаловедение традиционно рассматривает четыре масштабных уровня структуры материалов, при исследовании которых используются разные методы их изучения: макроструктура, микроструктура, субструктура, рентгеноструктура.
Макроструктура материалов изучается невооруженным глазом или с помощью лупы. При этом определяют особенности дендритного и волокнистого строения, вид излома, размер кристаллов и др.
Микроструктура материалов исследуется с помощью металлографических световых микроскопов при увеличении обычно от 100 до 1000-кратных. Такой метод позволяет изучать структурные составляющие материалов, размер, геометрическую форму и количество кристаллов, неметаллические включения и другие особенности микроструктуры.
Субструктура (мезоструктура) материалов выявляется при использовании электронных микроскопов. Применяются методы электронной просвечивающей микроскопии, растровой микроскопии при увеличениях от 3000 до 30000-кратных. Этими методами изучают структурные элементы внутри зерен: дислокации, ячейки, фрагменты и т.д.
С 1990-х гг. при исследованиях используются туннельные растровые микроскопы. Получаемые результаты представляют собой оцифрованный трехмерный массив в памяти компьютера, который изображается визуально с помощью лазерного принтера. Такая методика исследования структуры позволяет контролировать качество прецизионных поверхностей, процессы изнашивания и другие процессы нанотехнологий.
Рентгеноструктура (субмикроструктура) материалов изучается рентгенографическими методами. При этом определяются тип и параметры кристаллических решеток, структурные превращения, процессы при холодной деформации и последующем нагреве, другие вопросы.
Применение автоионного микроскопа, дающего увеличение в 5…10 млн. раз, позволяет наблюдать отдельные атомы в кристаллической решетке, точечные и другие дефекты строения материалов.
В рассмотренную классификацию структур сравнительно недавно на основе исследований последнего времени внесены уточнения. Современная классификация состоит из трех структурных уровней:
* макроструктура материалов, объединяющая два прежних уровня (макроструктура и микроструктура);
* мезоструктура материалов (субструктура);
* микроструктура материалов (рентгеноструктура).
Эта классификация приведена по данным Л. И. Тушинского с сотрудниками.
1.2. Основные понятия электронной теории металлов и зонной теории кристаллов.
Строение металлов представляется как совокупность положительно заряженных ионов и валентных электронов, ведущих себя подобно молекулам идеального газа (электронный газ). В соответствии с квантовой теорией свободных электронов в металле электронный газ рассматривается как квантовая система. Значения энергии электронов и их движение происходят по законам квантовой механики.
При температуре абсолютного нуля Т=0 в соответствии с принципом Паули на энергетических уровнях будут располагаться по два электрона с противоположными спинами. Они заполнят энергетические уровни с наибо-
лее низкими по энергии  квантовыми состояниями (рис. 1). С повышением температуры возбуждаются электроны на самых верхних уровнях, и они могут занять более высокие незанятые состояния.
Действие периодического поля кристаллической решетки из положительно заряженных ионов на движение валентных электронов учтено в зонной теории кристаллов. Рассматривается движение одного электрона в усредненном электрическом поле. Приближенные математические решения этой задачи показали, что в кристаллическом теле из множества ионов образуется много энергетических подуровней, отличающихся по величине энергии квантовыми состояниями (рис. 1). С повышением температуры возбуждаются электроны на самых верхних уровнях, и они могут занять более высокие незанятые состояния.
Действие периодического поля кристаллической решетки из положительно заряженных ионов на движение валентных электронов учтено в зонной теории кристаллов. Рассматривается движение одного электрона в усредненном электрическом поле. Приближенные математические решения этой задачи показали, что в кристаллическом теле из множества ионов образуется много энергетических подуровней, отличающихся по величине энергии  . На каждом подуровне может находиться только два электрона с . На каждом подуровне может находиться только два электрона с
|  Рис.1.Условная схема расположения элект- ронов по энергетичес- ким уровням.
противоположны-
Рис.1.Условная схема расположения элект- ронов по энергетичес- ким уровням.
противоположны-
|
ми спинами.
Совокупность подуровней образует в кристалле энергетически разрешенные зоны (полосы). Между ними расположен ряд чередующихся запрещенных зон, в которых не могут находиться валентные электроны.
По характеру заполнения электронами уровней разрешенной валентной зоны, ширины запрещенной зоны и расположению свободной зоны зонная теория кристаллов позволила объяснить существование металлов, полупроводников и диэлектриков (рис. 2).


Рис.2. Два варианта схемы расположения разрешенной (р.з.), запрещенной (з.з.) и свободной (с.з.) зон в кристаллах: а - металлы; б-полупроводники; в-диэлектрики.
В случае металлов верхние энергетические уровни разрешенной зоны свободны от электронов. При действии электрического поля или повышении температуры электроны переводятся на более высокие уровни, и создается возможность направленного движения электронов, т. е. возникновения электрического тока (рис. 1, а).
У кристаллических тел, называемых собственными полупроводниками, энергетические уровни верхней валентной зоны полностью заняты электронами, а ширина запрещенной зоны небольшая (рис.1,б). При нагревании часть электронов из верхних уровней валентной зоны переходит через запрещенную зону на нижние уровни свободной зоны. Эта зона становится зоной проводимости.
Для диэлектриков характерна широкая запрещенная зона. Тепловое движение не может обеспечить перевод электронов из разрешенной валентной в верхнюю свободную зону. В этом случае электропроводность не возникает.
1.3. Атомные орбитали и формирование ковалентных связей в полимерах, стеклах и углеграфитовых материалах.
При рассмотрении электронного строения атомов в квантовой механике полученную математическими расчетами плотность вероятности нахождения электрона на расстоянии r  от атомного ядра представляют графически. В химии такие зависимости изображаются в трехмерной системе координат в форме атомных орбиталей. Следовательно, атомной орбиталью называют область пространства вокруг атомного ядра, в которой наиболее вероятно нахождение электрона. Согласно расчетам квантовой механики, образуются s- , p-, d- орбитали, имеющие различную геометрическую форму ( рис. 3.)
от атомного ядра представляют графически. В химии такие зависимости изображаются в трехмерной системе координат в форме атомных орбиталей. Следовательно, атомной орбиталью называют область пространства вокруг атомного ядра, в которой наиболее вероятно нахождение электрона. Согласно расчетам квантовой механики, образуются s- , p-, d- орбитали, имеющие различную геометрическую форму ( рис. 3.)
Рис. 3. Геометрическая форма s-, p- , d- орбитали.
Изложенные представления относятся к изолированным отдельным атомам. При образовании химических соединений происходит перестройка электронной оболочки атомов. Первоначальная геометрическая форма и энергия атомных орбиталей взаимно изменяются, образуются орбитали новой одинаковой геометрической формы и одинаковой энергии. Это явление называется гибридизацией орбиталей, а новые орбитали - гибридными.
Наиболее часто встречаются три типа гибридизации атомных орбиталей (рис. 4.):
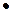 образование из одной s- и одной p- орбиталей двух новых sp- орбиталей. Они ориентируются под углом 180
образование из одной s- и одной p- орбиталей двух новых sp- орбиталей. Они ориентируются под углом 180  друг к другу, т. е. имеют линейную форму;
друг к другу, т. е. имеют линейную форму;
 образование из одной s- орбитали и двух p- орбиталей трех sp
образование из одной s- орбитали и двух p- орбиталей трех sp  - гибридных орбиталей, расположенных под углом 120
- гибридных орбиталей, расположенных под углом 120  в плоскости;
в плоскости;
 образование из одной s- орбитали и трех p- орбиталей четырех одинаковых sp
образование из одной s- орбитали и трех p- орбиталей четырех одинаковых sp  - орбиталей, которые вытянуты в направлениях к вершинам тетраэдра.
- орбиталей, которые вытянуты в направлениях к вершинам тетраэдра.

Рис. 4. Гибридизация орбиталей атомов: a- sp; б- sp  ; в- sp
; в- sp  .
.
Рассмотрим схему образования ковалентной связи между атомами. При сближении взаимодействующих атомов происходит перекрывание их гибридных атомных орбиталей (электронных облаков). Вследствие такого перекрывания плотность отрицательного электрического заряда в области между атомными ядрами в молекуле увеличивается. Положительно заряженные ядра притягиваются к области перекрывания орбиталей, в результате чего и образуется молекула. Уменьшение энергии системы при образовании ковалентной связи и ее детальный анализ рассматриваются в квантовой механике.
Существуют две разновидности ковалентной связи (рис. 5.):
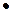
 - связь (сигма- связь), образованная при прямом перекрывании атомных орбиталей по прямой, соединяющей ядра атомов;
- связь (сигма- связь), образованная при прямом перекрывании атомных орбиталей по прямой, соединяющей ядра атомов;
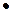
 - связь (пи- связь), образованная при боковом перекрывании их атомных орбиталей. При этом формируются две области перекрывания орбиталей своими периферийными частями.
- связь (пи- связь), образованная при боковом перекрывании их атомных орбиталей. При этом формируются две области перекрывания орбиталей своими периферийными частями.
Ковалентные связи имеют пространственную направленность.

Рис. 5. Схематическое изображение ковалентных связей: а-  - связь, б-
- связь, б-  - связь.
- связь.
Рассмотрим ковалентные связи, действующие в некоторых неметаллических материалах.
 Полимерные высокомолекулярные химические соединения имеют цепные макромолекулы, состоящие из большого числа повторяющихся звеньев, связанных между собой ковалентными связями. Наиболее многочисленный класс высокомолекулярных соединений составляют карбоцепные полимеры, величина энергии связи которых С-С составляет 348 кДж/ моль. В качестве примера показаны на рис. 6 ковалентные связи в макромолекуле полиэтилена …-СН
Полимерные высокомолекулярные химические соединения имеют цепные макромолекулы, состоящие из большого числа повторяющихся звеньев, связанных между собой ковалентными связями. Наиболее многочисленный класс высокомолекулярных соединений составляют карбоцепные полимеры, величина энергии связи которых С-С составляет 348 кДж/ моль. В качестве примера показаны на рис. 6 ковалентные связи в макромолекуле полиэтилена …-СН  – СН
– СН  – СН
– СН  -… Орбитали свободного атома углерода с электронной конфигурацией 1s
-… Орбитали свободного атома углерода с электронной конфигурацией 1s  2s
2s 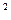 2p
2p 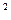 представлены на рис. 7.
представлены на рис. 7.

Рис. 6. Схема образования ковалентных связей в Рис. 7. Орбитали свободного
макромолекуле полиэтилена атома углерода.
В случае образования полиэтилена происходит sp 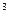 - гибридизация атомных орбиталей углерода и образование четырех гибридных орбиталей, направленных к вершинам тетраэдра. Макромолекула полиэтилена получает зигзагообразную геометрическую форму. Две орбитали каждого атома углерода перекрываются с орбиталями соседних атомов углерода, образуя ковалентные
- гибридизация атомных орбиталей углерода и образование четырех гибридных орбиталей, направленных к вершинам тетраэдра. Макромолекула полиэтилена получает зигзагообразную геометрическую форму. Две орбитали каждого атома углерода перекрываются с орбиталями соседних атомов углерода, образуя ковалентные  - связи.
- связи.
 Рис.8. Тетраэдрическое строение структуры неорганического силикат- ного стекла.
ставлено на рис. 9. Рис.8. Тетраэдрическое строение структуры неорганического силикат- ного стекла.
ставлено на рис. 9.
| Далее рассмотрим образование кова- лентных связей в неорганических сили- катных стеклах. Основу модели строения в стеклообразном состоянии составляют кремнекислородные группы SiO  в форме тетраэдров (рис. 8). Между катионами кремния Si и анионами кислорода О действуют преимущественно ковалент- ные связи с дополнительной ионной составляющей связи. Образование кова- лентных связей в цепочке Si-O-Si пред- в форме тетраэдров (рис. 8). Между катионами кремния Si и анионами кислорода О действуют преимущественно ковалент- ные связи с дополнительной ионной составляющей связи. Образование кова- лентных связей в цепочке Si-O-Si пред-
|
Приведено электронное строение свободных атомов кислорода (1s 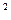 2s
2s 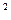 2p
2p  ) и кремния (1s
) и кремния (1s 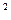 2s
2s 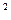 2p
2p  3s
3s 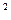 3p
3p 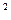 3d
3d  ). В стекле геометрическая форма орбиталей изменяется в результате sp – гибридизации у кислорода О и sp
). В стекле геометрическая форма орбиталей изменяется в результате sp – гибридизации у кислорода О и sp 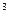 –гибридизации у кремния Si.
–гибридизации у кремния Si.
В результате перекрытия орбиталей после гибридизации формируются  - связь и
- связь и  - связь в горизонтальной плоскости и
- связь в горизонтальной плоскости и  - связь в вертикальной плоскости. Таким образом, образуется у тетраэдров SiO
- связь в вертикальной плоскости. Таким образом, образуется у тетраэдров SiO  тройная ковалентная связь Si
тройная ковалентная связь Si  O
O  Si. Величина энергии ковалентно - ионной связи в неорганическом силикатном стекле составляет 470 кДж/ моль.
Si. Величина энергии ковалентно - ионной связи в неорганическом силикатном стекле составляет 470 кДж/ моль.

Рис.9. Формирование ковалентных связей в неорганическом силикатном стекле:
а, б – электронное строение атомов кислорода О и кремния Si в свободном состоянии, в - электронное строение О и Si после гибридизации атомных орбиталей,г – образование  - связи и
- связи и  - связи цепочки Si -O- Si в стекле.
- связи цепочки Si -O- Si в стекле.
Ковалентные связи образуются в углеродных и графитовых материалах.
 Рис.10. sp
Рис.10. sp 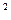 –гибридизация атомных орбиталей углерода С в графитовом слое. –гибридизация атомных орбиталей углерода С в графитовом слое.
| Для них характерно слоистое строение из шестиугольных циклов атомов углерода. Атомные орбитали для свободного атома углерода были приведены на рис. 7. В углеграфитовых материалах происходит sp 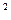 – гибридизация орбиталей (рис.10).
При этом в горизонтальной плос-кости перекрытие гибридизированных орбиталей означает образование – гибридизация орбиталей (рис.10).
При этом в горизонтальной плос-кости перекрытие гибридизированных орбиталей означает образование  -связей. В вертикальной плоскости вследствие взаимного перекрытия р -связей. В вертикальной плоскости вследствие взаимного перекрытия р  орбиталей фор- мируются орбиталей фор- мируются  - связи. - связи.
|
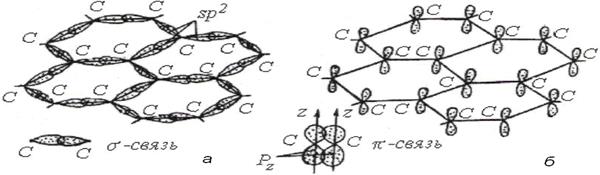 Рис. 11. Формирование у углеграфитового слоя ковалентных
Рис. 11. Формирование у углеграфитового слоя ковалентных  - связей в горизонтальной плоскости (а) и
- связей в горизонтальной плоскости (а) и  - связей в вертикальной плоскости (б).
- связей в вертикальной плоскости (б).
Энергия двойной ковалентной связи в углеродном слое С=С составляет 418…460 кДж/моль. Между соседними углеродными слоями действуют слабые межмолекулярные силы связи с величиной энергии связи 4…18 кДж/моль.
1.4. Кристаллические структуры материалов и дефекты в кристаллах.
Структура идеального монокристалла имеет строгую трехмерную периодичность и атомы расположены в узлах кристаллической решетки. Их расположение изображают в виде схем элементарных кристаллических ячеек, которые характеризуются длиной ребер и величиной углов (постоянными решетки). Число атомов, находящихся на наиболее близком и равном расстоянии от данного атома, называется координационным числом.
В зависимости от природы частиц в узлах кристаллической решетки и характера сил связи между частицами различают четыре физико-химических типа кристаллов:
1. Металлические, у которых положительно заряженные ионы в узлах кристаллической решетки взаимодействуют с электронами проводимости.
2. Ионные, характеризующиеся наличием ионной связи.
3. Атомные с нейтральными атомами в узлах и ковалентной связью между атомами.
4. Молекулярные, имеющие цепные параллельно расположенные макромолекулы, связанные силами Ван-дер-Ваальса.
Структурные типы кристаллов простых веществ разделяются по относительному расположению атомов или атомных групп на следующие разновидности (рис. 12.):
1.Кубическая гранецентрированная кристаллическая решетка (ГЦК).
2.Кубическая объемно- центрированная кристаллическая решетка (ОЦК).
3.Гексагональная плотноупакованная кристаллическая решетка (ГПУ).
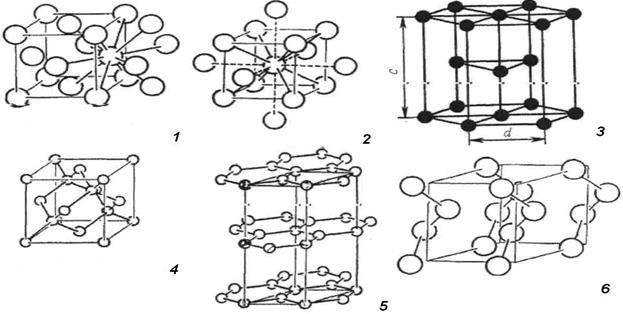
Рис. 12. Структурные типы кристаллических решеток простых веществ:1- ГЦК; 2- ОЦК; 3 – ГПУ; 4 – тип алмаза; 5- тип гексагонального графита; 6- тип цепной структуры.
4.Структурный тип алмаза.
5. Структурный тип гексагонального графита.
6. Цепные структуры из винтообразных атомных цепочек.
Реальные кристаллические структуры имеют отклонения от строгой периодичности, искажения решетки, связанные с тем или иным дефектом.
Различают дефекты макроскопических размеров (r >>  r
r  ) и микро- скопических(r
) и микро- скопических(r  r
r  ). Под r
). Под r  понимаются расстояния между соседними атома- ми (ионами) в кристаллах.
понимаются расстояния между соседними атома- ми (ионами) в кристаллах.
Дефекты в кристаллах по геометрической классификации подраз- деляются на следующие виды:
 точечные, когда искажения решетки во всех трех измерениях имеют микроскопические размеры;
точечные, когда искажения решетки во всех трех измерениях имеют микроскопические размеры;
 линейные, у которых в одном из измерений дефект имеет макроскопические размеры, а в двух других измерениях – микроскопические;
линейные, у которых в одном из измерений дефект имеет макроскопические размеры, а в двух других измерениях – микроскопические;
 поверхностные, когда в двух измерениях у дефекта макроскопические размеры, а в одном из измерений – микроскопические;
поверхностные, когда в двух измерениях у дефекта макроскопические размеры, а в одном из измерений – микроскопические;
 объемные трехмерные дефекты, когда размеры дефекта во всех трех измерениях макроскопические.
объемные трехмерные дефекты, когда размеры дефекта во всех трех измерениях макроскопические.
К точечным дефектам относятся вакансии, т. е. узлы решетки, в которых отсутствуют атомы, атомы в междоузлиях решетки, ионы примесей в узлах и междоузлиях, отклонения от простого соотношения количества анионов и катионов.
Линейные дефекты представляют собой дислокации, характеризующиеся смещением групп атомов. В случае, когда в кристалле имеется атомная полуплоскость, обрывающаяся вдоль некоторой линии, возникает краевая дислокация (рис.13, а). При наличии винтовой дислокации кристалл представляет собой фактически одну атомную плоскость, свернутую в виде винтовой лестницы (рис.13, б).


Рис.13. Схемы дислокаций: а – краевой; б – винтовой.
К поверхностным дефектам относятся границы зерен в поликристаллах, дефекты упаковки, т. е. нарушения в отдельных прослойках правильного чередования соседних атомных плоскостей в кристаллической решетке, и некоторые другие.
Объемными трехмерными дефектами являются включения других фаз, нарушения сплошности кристалла (трещины, поры).
1.5. Кристаллизация металлов.
В современной технике большинство металлов и сплавов получают путем расплавления и дальнейшей разливки жидкого металла в формы. Процесс образования кристаллов из жидкости называется кристаллизацией.
Особенности строения жидких металлов. По существующим представлениям жидкое состояние металлов более близко к кристаллическому, чем газообразному. Ранее предполагалось, что расположение атомов в жидкости имеет совершенно неупорядоченный характер в противоположность кристаллам, где частицы остаются в узлах кристаллической решетки. Рентгеноструктурное исследование расплавленных металлов показало, что в них в течение некоторого времени сохраняются группировки атомов с более или менее упорядоченным расположением, приближающимся к упорядоченности атомов, имеющейся в кристаллах. Эта упорядоченность, правильность расположения атомов имеет место для ближайших соседей данного атома (ближний порядок). По мере увеличения расстояния от данного атома упорядоченность расположения атомов в жидких металлах нарушается в отличие от кристаллов (дальний порядок). Группировки атомов с ближним порядком неустойчивы. В результате теплового движения они возникают, существуют некоторое время, распадаются, затем возникают в другом объеме жидкости и т. д.
Таким образом, при плавлении характер сил взаимодействия между частицами не изменяется. В отличие от твердых тел атомы в жидкостях часто перемещаются из одних центров равновесия в другие. Переход металлов из жидкого состояния в твердое не ведет к таким резким изменениям строения металла и его свойств, как переход в газообразное состояние.
Кристаллизация металлов. Для выявления температур начала и конца кристаллизации применяется термоанализ. По этому методу металл нагревается в тигле до расплавления, а затем медленно охлаждается до комнатной температуры. Во время нагрева или охлаждения записывают показания температуры. При переходе металла из одного состояния в другое выделяется или поглощается тепло, и поэтому на кривых, построенных в координатах « температура- время», наблюдаются температурные остановки. Кривые охлаждения металла показаны на рис. 14.
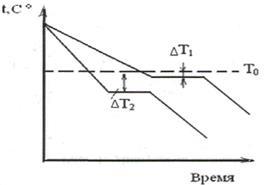
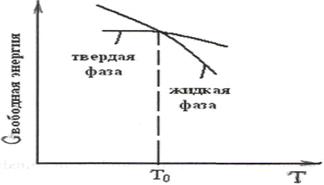
Рис.14. Кривые охлаждения Рис.15. Расчетные значения изменения свобод-
при кристаллизации металлов. ной энергии металла для жидкой и твердой фаз.
Устойчивость твердого или жидкого состояния (фаз) металла при определенных внешних условиях (температура, давление) определяется величиной свободной энергии фаз. В соответствии с законами термодинамики при заданных условиях более устойчивой будет фаза, имеющая минимум свободной энергии.
Изменения свободной энергии твердой и жидкой фаз при изменении температуры показано на рис.15. Из рассмотрения графика видно, что при температуре Т 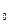 кривые свободной энергии пересекаются. Точка Т
кривые свободной энергии пересекаются. Точка Т 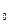 является равновесной температурой кристаллизации. При этой температуре твердая и жидкая фазы находятся в равновесии и существуют одновременно.
является равновесной температурой кристаллизации. При этой температуре твердая и жидкая фазы находятся в равновесии и существуют одновременно.
С понижением температуры ниже Т 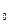 свободная энергия твердой фазы становится меньше по сравнению с жидкой. Следовательно, твердая фаза станет более устойчивой. Следует подчеркнуть, что процесс кристаллизации возможен лишь в случае переохлаждения металла ниже равновесной температуры Т
свободная энергия твердой фазы становится меньше по сравнению с жидкой. Следовательно, твердая фаза станет более устойчивой. Следует подчеркнуть, что процесс кристаллизации возможен лишь в случае переохлаждения металла ниже равновесной температуры Т 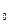 . Разность между температурой Т
. Разность между температурой Т 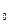 и фактической температурой кристаллизации Т
и фактической температурой кристаллизации Т  называется степенью переохлаждения
называется степенью переохлаждения 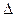 Т:
Т: 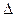 Т= Т
Т= Т 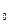 - Т
- Т  .
.
Процесс кристаллизации происходит в две стадии. Вначале в определенных объемах образуются центры кристаллизации. Центры кристаллизации представляют собой мелкие устойчивые, зародившиеся в жидком металле. Вследствие наличия в жидкости ближнего порядка возможно образование группировок атомов, близких по своей конфигурации к строению кристаллической решетки. Эти группировки атомов являются основой для зарождения будущих центров кристаллизации. Во второй стадии кристаллизации происходит рост кристаллов с определенной скоростью из образовавшихся центров. Схема процесса кристаллизации металлов по И. П. Миркину показана на рис.16.

Рис. 16. Схема развития процесса кристаллизации металла.
Скорость образования центров кристаллизации Ч.Ц. линейная скорость роста кристаллов С.Р. зависят от температуры кристаллизации, т. е. от степени переохлаждения 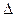 Т ниже равновесной температуры Т
Т ниже равновесной температуры Т 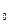 (рис. 17) . Из графика видно, что при степени переохлаждения
(рис. 17) . Из графика видно, что при степени переохлаждения 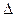 Т=0 ( Т
Т=0 ( Т  =Т
=Т 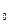 ) центры кристаллизации не образуются , т.к. свободные энергии жидкой и твердой фаз одинаковы. С понижением температуры скорости образования центров и роста кристаллов возрастают, достигают максимума и далее понижаются. При низких температурах вследствие уменьшения диффузии и малой подвижности атомов обе скорости равны нулю.
) центры кристаллизации не образуются , т.к. свободные энергии жидкой и твердой фаз одинаковы. С понижением температуры скорости образования центров и роста кристаллов возрастают, достигают максимума и далее понижаются. При низких температурах вследствие уменьшения диффузии и малой подвижности атомов обе скорости равны нулю.
 Рис.17.Схема зависимости коли- чества центров кристаллизации и линейной скорости роста кристаллов от степени переохлаждения. Рис.17.Схема зависимости коли- чества центров кристаллизации и линейной скорости роста кристаллов от степени переохлаждения.
| На практике в обычных условиях охлаж- дения наблюдаются только восходящие ветви кривых. Рассматриваемые кривые позволяют дать качественную картину процесса кристаллизации. Число центров возрастает с увеличением степени пере- охлаждения и поэтому при больших переохлаждениях формируется более мел- козернистый металл. В случае малого переохлаждения, при медленном охлаж- дении число центров небольшое и ме- талл получает крупнозернистое строение. Большая степень переохлаждения жидкого металла достигается быстрым охлаж- дением. |
Из общих закономерностей кристаллизации следует, что при особо большом переохлаждении жидкого расплава число центров кристаллизации становится равным нулю и кристаллизация прекращается. Вследствие возрастания вязкости расплава при этом формируется металлический материал аморфного строения. Для получения аморфного состояния металлов необходимы очень высокие скорости охлаждения при переходе из жидкой фазы. Эти скорости должны достигать 10 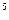 …10
…10  градусов в секунду.
градусов в секунду.
Обеспечение требуемой для получения аморфного состояния скорости охлаждения достигается заливкой жидкого расплава тонким слоем h = 30…40 мкм на поверхность вращающегося бронзового барабана с принудительным внутренним охлаждением (частота вращения составляет до 800 мин  ). В результате получается тонкая лента шириной до 100 мм металлического материала аморфного строения.
). В результате получается тонкая лента шириной до 100 мм металлического материала аморфного строения.
К переходу в аморфное состояние более склонны расплавы, содержащие некоторое количество неметаллических составляющих. К таким материалам аморфного строения относятся: Fe  Si
Si  B
B  C
C  , Pd
, Pd  Si
Si  Cu
Cu  , Fe
, Fe  B
B  и др.
и др.
Аморфное состояние может быть получено и способом распыления жидкого расплава нейтральным газом в мелкий порошок. С уменьшением размера частиц получаемого порошка степень аморфизации материала возрастает да 100  .
.
Аморфизацию тонкого поверхностного слоя металлических материалов можно получить с помощью лазерного излучения на этапе охлаждения расплавленного слоя материала. Вследствие технологических сложностей и значительной трудоемкости способ не получил особого применения.
Данные о применяемых металлических материалах аморфного строения приведены в разделе 4.5.
В технических металлах вследствие наличия в расплавленных металлах нерастворимых частиц примесей и влияния наружных поверхностей стенок литейных форм центры кристаллизации легко образуются на поверхности этих частиц и стенок. Поэтому строение реального слитка металла определяется способом производства слитка и количеством и характером примесей в металле.
Процесс кристаллизации реальных металлов значительно осложнен благодаря образованию и росту кристаллов сложной разветвленной формы – дендритов. Дендритное строение образуется в результате различий в скорости роста различных граней кристалла.
Кристаллизация жидкого металла в форме начинается в поверхностном слое, у стенок формы. В этом слое металл в первую очередь переохлаждается и образуется большое количество мелких дендритов (мелкозернистая корка). Далее в направлении отвода тепла от жидкого металла, примерно перпендикулярно к поверхности формы происходит рост столбчатых кристаллов. По мере роста столбчатых кристаллов скорость охлаждения жидкого металла внутренней зоны становится одинаковой во всех направлениях. Направленный рост кристаллов прекращается, создаются условия для образования зародышей во внутренней зоне и растут равноосные кристаллы.
Таким образом, в литом металле образуются три структурные зоны: 1-мелкозерныстых; 2-столбчатых; 3-равноосных кристаллов. В качестве примера на рис.18 показана схема строения стального слитка спокойной стали. У некоторых пластичных цветных металлов (например, меди и ее сплавах) стремятся для получения более плотного слитка получить во всем объеме столбчатые кристаллы без образования зоны равноосных кристаллов.
 Рис. 18. Схема строения слитка спокойной стали.
Рис. 18. Схема строения слитка спокойной стали.
| При кристаллизации слитков вследствие уменьшения объема при переходе металла из жидкого состояния в твердое образуется в верхней части слитка, которая затвердевает последней, усадочная раковина. Ниже расположена усадочная рыхлость. В зоне равноосных кристаллов образуются усадочные поры. Величина зерна металла может ре- гулироваться путем искусственного введения в жидкий металл малых добавок специальных примесей (модификаторов). Эти примеси служат центрами кристаллизации или уменьшают скорость роста зерна металла и изменение их количества (модифицирование). |
Полиморфные превращения металлов. У некоторых металлов (железо, титан и др.) на кривых охлаждения, кроме температурной остановки, характеризующей кристаллизацию металла, наблюдаются температурные остановки в твердом состоянии. Во время этих температурных остановок происходит изменение строения кристаллической решетки (полиморфное или аллотропическое превращение). В качестве примера на рис.19 приведена кривая охлаждения железа. Полиморфные превращения так же, как и процесс кристаллизации, обусловлены изменением величины свободной энергии фаз с различной кристаллической решеткой.
 Рис.19. Кривая охлаждения железа.
Рис.19. Кривая охлаждения железа.
| Процесс полиморфного превращения идет путем образования центров новой фазы и ее роста. При этом происходит полный процесс пе- рекристаллизации, т. е. образуются новые зерна с новыми границами, и меняется микроструктура металла. Характерной особенностью поли- морфных превращений является закономерная ориентировка кристал- лических решеток новых зерен по отношению к решетке исходных зерен. Расположение атомов на соприкасающихся гранях зерен (кристаллов) исходной и новой фазы должно быть сходным, а расстояния между атомами отличаться незна- чительно. |
1.6. Фазовые превращения и строение металлических материалов
Металлические материалы в зависимости от характера физико-химического взаимодействия образующих их компонентов имеют структуру из следующих фаз: жидкие растворы, химические соединения, растворы в твердом состоянии («твердые» растворы), промежуточные фазы. Изменение температуры и состава материала, давления оказывают влияние на структуру и устойчивость тех или иных фаз.
Влияние температуры и концентрации на фазовые области в равновесных условиях, соответствующих минимальному значению свободной энергии, представляют в графической форме. Графические диаграммы типа « фазовые области = f (концентрация x 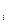 ; температура y
; температура y 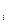 )» называются диаграммами состояния (фазового равновесия). По современным понятиям диаграммы состояния представляют собой банки данных в графической форме о фазовых областях (строении материалов) в зависимости от изменения химического состава материала и температуры при постоянном давлении в равновесных условиях. По диаграммам состояния анализируют фазовые переходы первого рода (фазовые превращения) одних фаз в другие и рассматривают вопросы структурообразования материалов.
)» называются диаграммами состояния (фазового равновесия). По современным понятиям диаграммы состояния представляют собой банки данных в графической форме о фазовых областях (строении материалов) в зависимости от изменения химического состава материала и температуры при постоянном давлении в равновесных условиях. По диаграммам состояния анализируют фазовые переходы первого рода (фазовые превращения) одних фаз в другие и рассматривают вопросы структурообразования материалов.
Диаграммы состояния двухкомпонентных систем весьма многообразны и в них образуются различные фазы. Рассматривают взаимодействие фаз отдельно в жидком состоянии и в твердом состоянии. Как правило, в жидком состоянии имеет место полная (неограниченная) растворимость при любом соотношении компонентов с образованием жидких растворов.
В твердом состоянии происходит следующие основные виды взаимодействия компонентов:
- полная растворимость компонентов при любом их соотношении с образованием твердых растворов;
-ограниченная растворимость компонентов с образование твердых растворов;
- полная нерастворимость компонентов без образования твердых растворов;
-образование устойчивых и неустойчивых химических соединений между компонентами;
- образование промежуточных фаз переменного состава.
Различным видам взаимодействия компонентов соответствует разная «геометрия» диаграмм состояния, расположение линий фазовых превращений (наклонных и горизонтальных). Ниже рассмотрены основные виды диаграмм состояния и приведены анализы фазовых превращений для типовых сплавов при их охлаждении.
Полная растворимость компонентов в жидком и твердом состояниях.
На диаграмме состояния (рис.20,а) имеются линии начала кристаллизации сплавов (ликвидус CmД) и окончания кристаллизации (солидус CnД). У сплава x  точкам 1 и 2 отвечают перегибы на кривой охлаждения. Процесс фазового перехода
точкам 1 и 2 отвечают перегибы на кривой охлаждения. Процесс фазового перехода 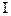 рода для с<
рода для с<
| <== предыдущая лекция | | | следующая лекция ==> |
| Контроль доступа к файлам | | | Расчет посадки с натягом |
Дата добавления: 2020-10-25; просмотров: 194;










