Химические свойства
1.Реакции восстановления нитрогруппы.
Впервые были осуществлены в Казани в 1841 году Н.Н.Зининым (учитель А.М.Бутлерова). Нитросоединения приобрели важнейшее практическое значение ввиду того, что нитросоединения ароматического ряда – вещества легко доступные, а ароматические амины и другие вещества, получаемые при восстановлении нитросоединений, необходимы для производства красителей, лекарств, фотохимикатов, антиоксидантов, полимерных материалов.
Реакция восстановления нитросоединений ароматического ряда может привести к образованию различных продуктов. Решающую роль в направлении реакции играет среда.
1) Восстановление в нейтральной, слабокислой или слабощелочной среде (действие Fe+H2O, электрохимическое восстановление в нейтральной среде).

| 2H 2H
+ 2H  H2O + C6H5-N=O H2O + C6H5-N=O  C6H5-NH-OH C6H5-NH-OH  C6H5NH2 + H2O
нитрозобензол фенилгидроксиламин анилин C6H5NH2 + H2O
нитрозобензол фенилгидроксиламин анилин
|

|
Эту реакцию можно остановить на любой стадии. Фенилгидроксиламин может давать перегруппировку в п-аминофенол, если его поместить в кислую среду.
2) при проведении реакции восстановления в сильнокислой среде промежуточные соединения те же, но реакция идет так быстро, что остановить ее на промежуточных стадиях не удается. Конечный продукт – анилин. Восстановители – Zn, Fe+кислота, H2S.
3) Восстановление в щелочной среде.
Идет более сложно.
+2H
С6H5NO2 + 2H  C6H5N=O
C6H5N=O  C6H5NHOH
C6H5NHOH
-H2O
нитробензол фенилгидроксиламин
| С6H5-N=O + | 
|
 H2O + H2O +
| 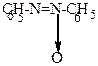
| 2H

|
| Азоксибензол | ||||
2H 2H
 H2O + C6H5-N=N-C6H5 H2O + C6H5-N=N-C6H5  C6H5-NH-NH-C6H5 C6H5-NH-NH-C6H5  2C6H5NH2
азобензол гидразобензол 2C6H5NH2
азобензол гидразобензол
|
Восстановление нитросоединений можно проводить и молекулярным водородом в присутствии катализаторов Cu, Pd, Ni.
II. Реакции в ядре
1) Реакции электрофильного замещения в ароматическом ядре.
Происходят в м-положении к нитрогруппе (т.к. это заместитель II рода) и протекает значительно труднее, чем у углеводородов.
а) галоидирование

|
(Fe)
+ Br2  HBr +
t0 HBr +
t0
| 
|
| м-бромнитробензол |
б) нитрование – требует более высокой температуры.
в) сульфирование – только олеумом или хлорсульфоновой кислотой (т.е. хлорангидрид серной кислоты).
2) Реакции нуклеофильного замещения в ароматическом ядре.
Являясь сильным электроноакцептором, нитрогруппа понижает электронную плотность кольца и особенно сильно в о- и п-положении, поэтому в этих положениях могут довольно легко идти реакции нуклеофильного замещения, которые почти не имеют места у ароматических углеводородов.
а) нуклеофильное замещение водорода в о- или п-положении к нитрогруппе.
1. Взаимодействие со щелочами

|
t0
+ KOH  H2 +
(тв.) H2 +
(тв.)
| 
|
| О-нитрофенолят калия |
Нуклеофильное замещение идет легче, если в молекуле имеются две нитрогруппы в м-положении.

|
+ KOH  H2 +
(раствор) H2 +
(раствор)
| 
|
| м-динитробензол | 2,6-динитрофенолят калия ярко-фиолетовое окрашивание |
б) нуклеофильное замещение других атомов или групп, находящихся в о- или п-положениях к нитрогруппе (особенно легко замещаются галогены в о- или п-положении к нитрогруппе).
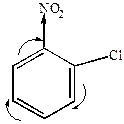
|
+ KOH  KCl +
(водный) KCl +
(водный)
| 
|
| о-хлорнитробензол | о-нитрофенол |
Реакция с замещением галоида в этом случае идет легко.
II. Нитросоединения с группой NO2 в боковой цепи
Например, фенилнитрометан C6H5-CH2-NO2
или метилфенилнитрометан (1-фенил-1-нитроэтан)

Способы получения
1. Нитрование гомологов бензола в условиях реакции Коновалова (действие разбавленной азотной кислоты при нагревании).
2. Замещение галогена в боковой цепи на NO2.
C6H5-CH2Cl + NaNO2  C6H5-CH2NO2 + NaCl
C6H5-CH2NO2 + NaCl
хлористый бензил нитрит натрия фенилнитрометан
Химические свойства ароматических нитросоединений с группой NO2 в боковой цепи
По свойствам сходны с нитросоединениями жирного ряда, но обладают большей склонностью к изомеризации в аци-форму, т.к. обладают исключительной подвижностью водорода в  -положении к группе NO2.
-положении к группе NO2.

|
| 
|
+NaOH
 H2O + H2O +
| 
|
| нейтральная форма (фенилнитрометан) | аци-форма | натриевая соль аци-формы | ||
 таутомеры
таутомеры
|
При подкислении соли аци-формы ее можно выделить в свободном состоянии.
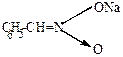
|
+ HCl  NaCl + NaCl +
| 
|
Способность аци-формы существовать в свободном состоянии обуславливается сопряжением двойной связи с  -электронами ароматического ядра и неподеленной парой р-электронов кислорода гидроксильной группы.
-электронами ароматического ядра и неподеленной парой р-электронов кислорода гидроксильной группы.

ЛЕКЦИЯ 6
Дата добавления: 2020-10-14; просмотров: 152;










