Факторы, влияющие на скорость реакции
| Фактор | Пример (обоснование) |
| Природа реагирующих веществ | Щелочные металлы реагируют с водой с различной скоростью: чем больше атомный радиус металла, тем легче открываются валентные электроны и взаимодействие протекает энергичнее |
| Концентрация (газы и растворы) | Горение веществ в чистом кислороде происходит активнее, чем в обычном воздухе, поскольку чем выше количество частиц реагентов в единице объема, тем больше частота столкновений, которые обусловливают скорость реакции |
| Для веществ в твёрдом состоянии- поверхность реагирующих веществ | Железо и сера реагируют только после измельчения и перемешивания, т.к. при этом увеличивается площадь соприкосновения реагентов |
| Температура | При обычных условиях кислород медленно окисляет вещества, а при более высокой температуре происходит их горение. Чем выше температура, тем больше кинетическая энергия молекул, тем энергичнее процесс реакции. Правила Вант- Гоффа: при повышении температуры на 10° скорость реакции возрастает в 2-4 раза |
| Присутствие особых веществ | Катализаторы ускоряют ход реакции. Ингибиторы замедляют ход реакции. Соляная кислота в присутствии уротропина становится инертной по отношению к металлам. Катализаторы могут участвовать в реакциях с образованием высокореакционноспособных промежуточных соединений |
Вопрос 3. В трех пробирках находятся серная кислота, фосфорная кислота, азотная кислота. Определите, в какой пробирке находится каждая кислота.
Ответ. Можно воспользоваться характерными химическими реакциями:
3AgNO3 + Na3PO4 = Ag3PO4↓ + 3NaNO3,
3Ag+ + PO43- = Ag3PO4↓;
(желтый осадок)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl,
Ba+ + SO42- = BaSO4↓;
(белый
кристаллический осадок)
4HNO3(конц.) + Cu 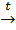 2NO2↑ + 2H2O + Cu(NO3)2.
2NO2↑ + 2H2O + Cu(NO3)2.
(бурый газ)
Билет № 16
Вопрос 1. Белки. Их состав, структура и свойства. Значение белков в живой природе.
Ответ.Белки – сложные высокомолекулярные природные соединения. Молекулы белков построены из остатков  - аминокислот, соединенных пептидными связями.
- аминокислот, соединенных пептидными связями.
Белок- полипептид, в состав которого входит около 20 видов аминокислот.
Структура
Первичная структура белка- свойственная данному белку последовательность аминокислотных остатков.
Вторичная структура белка- спиральная пространственная конфигурация полипептидной цепи, поддерживаемая за счет водородных связей С=О•••Н-N.
Третичная структура белка- специфическое взаимное расположение участков спиральной цепи молекулы белка и отдельных молекул. Третичная структура обусловлена наличием дисульфидных, сложноэфирных и солевых мостиков, а также межмолекулярных водородных связей.
Четвертичная структура белка- полимерные соединения белков, где «мономерами» являются макромолекулы белка.
Физические свойства
Белки бывают растворимые в воде- гидрофильные- и нерастворимые- гидрофобные.
Химические свойства
1. Денатурация – процесс необратимого свертывания белков, связанный с разрушением исходной структуры. Денатурация происходит при высоких температурах, действии радиации, солей тяжелых металлов, химических веществ( кислот, щелочей, спиртов).
2. Гидролиз белков и присутствие кислот, щелочей или ферментов- расщепление белков на составляющие их аминокислоты.
3. Квантопротеиновая реакция- окрашивание белков в желтый цвет при действии концентрированной азотной кислоты- метод обнаружения остатков ароматических аминокислот.
4. Биуретовая реакция- взаимодействие белка со свежеприготовленной суспензией Cu(OH)2 , сопровождающееся появлением красно-фиолетового окрашивания- реакция на пептидной группы.
5. Реакция белка с ацетатом свинца при нагревании в щелочной среде. Выпадение черного осадка PbS указывает на содержание серы в белке.
Значение белков в природе
Функции белков в живых организмах следующие : строительная ( из белков состоят тела всех живых существ), двигательная ( актин, миозин), транспортная( гемоглобин), защитная (специфические реакции иммунитета- антитела), сигнальная ( белки, плазмалеммы, рецепторы), каталитическая ( пепсины, расщепляют белки), регуляторная ( инсулин участвует в обмене углеводов).
Вопрос 2. Неорганические и органические кислоты, их классификация, строение, свойства.
Ответ. Кислоты-вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы водорода:
HNO3 ↔ H+ + NO-3.
кислота катион кислотный
водорода остаток
Классификацию кислот нагляднее представить в виде таблицы. Формулу кислоты можно представить в виде Э(OH)nOm. Сила кислоты тем больше, чем больше число m и меньше n.
Химические свойства
1. Взаимодействие с основаниями (реакция нейтрализации):
HCl + KOH = KCl + H2O,
CH3COOH + KOH = CH3COOK + H2O.
2. Взаимодействие с активными металлами :
2HCl + 2K = 2KCl + H2↑,
2CH3COOH + 2K = 2CH3COOK + H2↑.
3. Взаимодействие с оксидами металлов :
2HCl + K2O = 2KCl + H2O,
2CH3COOH + K2O = 2CH3COOK + H2O.
4. Менее летучие кислоты вытесняют более летучие из их солей:
H2SO4(разб.) +Na2SO4 + H2S↑.
5. Сильные минеральные кислоты вытесняют органические кислоты из их солей :
CH3COOK + HCl = CH3COOH + KCl.
6. Реакция этерификации кислот спиртами:
C2H5OH + H2SO4 = C2H5 – O – SO3 – H + H2O.
этилсульфат
Вопрос 3. В трех пробирках находятся водные растворы муравьиной кислоты, фенола и глюкозы. С помощью химических реакций определите, в какой пробирке какое вещество.
Ответ.1) При взаимодействии фенола и FeCl3 образуется раствор коричнево-фиолетовый цвета с запахом туши :
3C6H5OH + FeCl3 = (C6H5O)3Fe + 3HCl.
2) При действии на глюкозу Cu(OH)2 при нагревании выпадает красный осадок Cu2O.
3) при добавлении к HCOOH лакмуса появляется красное окрашивание. А также :
HCOOH + Ag2O 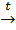 2Ag↓ + H2O + CO2↑.
2Ag↓ + H2O + CO2↑.
NH3(р-р)
Билет №17
Вопрос 1. Диеновые углеводороды. Их строение, свойства, получение и применение.
Ответ: К диеновым углеводородом относятся органические соединения общей формулой CnH2n-2, в молекулах которых имеются две двойные связи.
Практически значимыми диеновыми углеводородами являются бутадиен -1,3 или дивинил.
CH2=CH-CH=CH2 ( группа атомов CH2=CH- называется винилом) и 2 – метилбутадиен -1,3 или изопрен.
CH2=C(CH3) –CH=CH2
Физические свойства
Бутадиен-1,3 при нормальных условиях – газ, который сжимается при -4,50С; 2-метилбутадиен -1,3-летучая жидкость, кипящая при температуре 34,10С.
Химические свойства:
1.Бромирование:
CH2=CH-CH=CH2 + Br2 = CH2Br-CH=CH-CH2Br
Бутадиен -1,3 1,4-дибромбутен-2
2.Реакции полимеризации.
Получение:
1.Дегидратация и дегидрирование спиртов ( по С.В. Лебедеву):
t, кат.
2CH3CH2OH=CH2=CH-CH=CH2 + 2H2O + H2↑
2.Дегидрирование бутана:
t, кат.
CH3CH2CH2CH3 = CH2 =CH-CH-CH2+ 2H2↑.
Применение диенов
Наибольший интерес представляют сопряженные диены, в которых двойные связи разделены одной простой связью, например изопрен
CH2= C( CH3) – CH=CH2
в хлоропрен
СH2= CCl-CH=CH2.
Эти диены используют для синтеза изопренового
( - CH2-C(CH3)=CH-CH2-)n
И хлоропренового
( - CH2-CCl=CH-CH2 -)n
Каучуков.
Вопрос 2. Электролиз. Основные схемы электролиза.
Ответ: Химические реакции, протекающие под действием электрического тока, на электродах, помещённых в расплав, раствор или твёрдый электролит, называют электролизом.
Электролиз расплава хлорида натрия ( платиновые электроды):
анод: Cl— e= 1/2Cl2 ( процесс окисления),
катод:Na+ + e= Na0 ( процесс восстановления).
Суммарная реакция:
2NaCl = 2Na + Cl2
Электролиз раствора хлорида меди ( угольные электроды):
Анод: 2Cl- - 2e = Cl2
Катод: Cu2+ + 2e = Cu0.
Суммарная реакция:
2H2O = 2H2 + O2
Аналогично происходит электролиз водного раствора нитрата калия ( платиновые электроды)
Электролиз сульфата цинка ( графитовые электроды):
Анод: 2H2O -4e = O2 + 4H+
Катод:Zn2+ + 2e = Zn0.
Суммарная реакция:
2ZnSO4 + 2H2O =2Zn + O2+ 2H2SO4
Электролиз раствора сульфата меди(медные электроды)-электрохимическое рафинирование:
анод: Cu0 – 2e = Cu2+,
катод: Cu2+ + 2e = Cu0.
Концентрация сульфата меди в растворе остается постоянной. Процесс сводится к переносу материала анода на катод. Это и есть рафинирование.
При составлении схем электролиза той или иной соли нужно помнить следующее.
1. Катионы металлов, имеющие стандартный электродный потенциал (сэп) больший, чем у водорода (от меди по золото включительно), при электролизе практически полностью восстанавливаются на катоде.
2. Катионы, имеющие значение сэп меньшее, чем у водорода, но большее, чем у алюминия, при электролизе практически полностью восстанавливаются одновременно с водой.
3. Катионы, имеющие еще меньший сэп(от лития по алюминий включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды до водорода.
4. Если водный раствор содержит смесь катионов различных металлов, например Ag+ , Cu2+ , Fe2+ ,то из этой смеси первым восстановится серебро, затем медь и последним железо.
5. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. Анионы S2- , I-, Br - , Cl- окисляются легко. Если раствор содержит анионы кислородосодержащих кислот SO2- , NO-3 , CO32- ,PO3-4, то на аноде окисляются молекулы воды до кислорода.
6. Если анод растворимый, то при электролизе он сам подвергается окислению, т.е. посылает электроны во внешнюю цепь. В результате смещается равновесие между электродом и раствором, и анод растворяется.
Ряд напряжений металлов :
Усиление восстановительной способности
Li, Cs, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Pb, H2, Cu, Ag, Hg, Pt, Au.
Усиление окислительной способности
Вопрос 3. К 200 г 35%-го раствора нитрата калия добавили 150 г воды. Определить концентрацию нитрата калия в новом растворе.
Ответ.
Дано: Найти :
m1(р-ра KNO3) = 200 г, ω2(KNO3) = ?
ω1(KNO3) = 35%,
m(H2O) = 150 г.
Решение :
m(KNO3) = 200*35/100 = 70 г,
m2 (р-ра KNO3) = 200 + 150 = 350 г,
ω2 (KNO3) = (70/350) * 100 = 20%.
Ответ. ω2 (KNO3) = 20%.
Билет № 18.
Вопрос 1. Циклопарафины. Их строение, свойства, получение и применение.
Ответ.В отличие от предельных углеводородов, в молекулах которых все углеродные атомы образуют открытые цепи, имеются углеводороды с замкнутыми цепями (циклами).
Известны циклопарафины, молекулы которых состоят из трех, четырех, пяти, шести и более атомов углерода :
СH2 CH2 - CH2 CH2 CH2 CH2
CH2 - CH2 CH2 - CH2 CH2 CH2 CH2 CH2
CH2 – CH2 CH2 – CH2
циклопропан циклобутан циклопентан циклогексан
У циклопарафинов возможна изомерия. Изомерия этих соединений связана с наличием боковых углеводородных цепей.
Например, молекулярной форме C2H12 соответствует несколько веществ-изомеров :
циклогексан, метилциклопентан, диметилциклобутан.
Общая формула циклоалканов -CnH2n.
Нахождение в природе
Циклопарафины находятся главным образом в составе некоторых нефтей. Отсюда и другое название циклопарафинов – нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены В.В. Марковниковым.
Получение
В лаборатории циклопарафины получают из дигалогенпроизводных предельных углеводородов, действуя на них активными металлами. Циклопарафины можно выделить из нефти.
Физические свойства
Циклопропан и циклобутан при нормальных условиях – газы, а циклогексан – жидкости. Циклопарафины в воде практические не растворяются.
Химические свойства
1. Реакция гидрирования :
цикло-C3H6 + H2  C3H8.
C3H8.
циклопропан пропан
2. Реакция замещения (для соединений с большими циклами) :
цикло-C6H12 + Cl2  C6H11Cl +HCl.
C6H11Cl +HCl.
циклогексан монохлорциклогексан
3. Реакция дегидрирования :
C6H12  C6H6 + 3H2.
C6H6 + 3H2.
циклогексан бензол
Применение
Из циклопарафинов практическое значение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды – бензол, толуол, и другие вещества, которые широко используются для синтеза крестителей, медикаментов и т.д. Циклопропан применяют для наркоза.
Вопрос 2. Валентность и валентные возможности атомов.
Ответ. Понятие валентности имеет смысл применять только к соединениям с ковалентным типом связи. В ионных соединениях говорят о заряде иона.
Валентность – количество ковалентных связей, которое образует атом в данном соединении. Количество валентных связей атома равно количеству общих электронных пар атома равно суммарному числу неспаренных электронов, неподеленных электронных пар и вакантных орбиталей, этого атома, участвующих в образовании химических связей.
Максимальная валентность, которую может проявлять элемент в соединениях, равна номеру группы этого элемента в таблице Д.И. Менделеева.
Например, в соединении CO степень окисления углерода +2, валентность II. В соединениях CO2 B CCl4 степень окисления углерода +4, валентность IV.
В формировании химических связей участвуют электроны атома, находящиеся на внешнем энергетическом уровне.
Вопрос 3. 20 г технического натрия, содержащего 10% примеси, растворили в избытке воды. Найти объем выделившегося газа водорода.
Ответ.
Дано: Найти:
m(Naтехн) = 20 г, V(H2) = ?
ω(примеси) = 10%.
Решение
m (Na) = 20 – (20*0?1) = 18 г.
18 г x л
2Na + 2H2O = 2NaOH + H2↑.
v: 2 моль 1 моль
M: 23г/моль Vм = 22 л/моль
m: 46 г
V(H2) =18 * 22,4/46 = 8,77 л
Ответ. V(H2) = 8,77 л.
Билет № 19.
Дата добавления: 2016-07-18; просмотров: 1337;










