Классификация химических реакций
Биологически важные реакции, кислотность и основность органических соединений. Строение и свойства поли- и гетерофункциональных соединений
Кислотность и основность органических соединений.
Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда и теория Льюиса.
По теории Льюиса кислотные и основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи.
По теории Бренстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н+.
Кислоты Бренстеда (протонные кислоты) – нейтральные молекулы или ионы, способные отдавать протон (доноры протонов).
Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов).
В зависимости от природы элемента, с которым связан протон, различают ОН- кислоты (карбоновые кислоты, спирты), SH-кислоты (тиолы), NН-кислоты (амиды, имиды), СН-кислоты (углеводороды, например, алкины с концевой тройной связью). Самыми сильными кислотными свойствами обладают карбоновые кислоты, основными – амины.
Наличие в молекуле электроноакцепторных групп, обладающих отрицательными электронными эффектами (смещающих электронную плотность связи от атома углерода к гетероатому функциональной группы), увеличивает положительный заряд на протоне, что приводит к усилению кислотных свойств. Наличие электронодонорных заместителей (смещающих электронную плотность связи от функциональной группы к атому углерода) увеличивает основность органических соединений.
 Так, например, кислотность хлоруксусной кислоты выше по сравнению с уксусной кислотой, а основность диметиламина выше, чем у метиламина.
Так, например, кислотность хлоруксусной кислоты выше по сравнению с уксусной кислотой, а основность диметиламина выше, чем у метиламина.
Классификация химических реакций
1. По изменению числа частиц в ходе реакции выделяют реакции
замещения, присоединения, отщепления, разложения, изомеризации.
Реакции замещения:атом или группа атомов в молекуле органического
соединения замещается на другой атом (или атомную группировку):
АВ + С→ АС + В
Примеры:
C2H6 + Cl2 (на свету)→CH3CH2Cl + HCl хлорирование этана
CH3CH2Cl + KOH (водн. р-р) → CH3CH2OH + KCl щелочной гидролиз хлорэтана
Реакции присоединения:молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются: А + В→С
Примеры:
CH2=CH-CH3 + Br2 →CH2Br-CHBr-CH3 бромирование пропена
CH2=CH2 + H2O→CH3CH2OH гидратация этилена
К реакциям присоединения относятся также реакции полимеризации: n A → An
Например, образование полиэтилена: n CH2=CH2→(-CH2-CH2-) n
Реакции отщепления (элиминирования): происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
А→ В + С
Например:
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
CH3-CH2Cl →CH2=CH2 + HCl
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH→CH2=CH2 + H2O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
CH3-CH3 →CH2=CH2 + H2 дегидрирование этана
Реакции разложения:из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ: А→ В + С + . . .
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов: CnH2n+2→ CmH2m+2 + CpH2p
Например
C10H22→ C5H12 + C5H10
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 oC)
Реакции изомеризации:происходит переход отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава, т.е. исходное вещество и продукт реакции являются изомерами (структурными или пространственными): А → В
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
CH3-CH2-CH2-CH2-CH3 ® CH3-CH(CH3)-CH2-CH3
2. По электронной природе реагентов различают нуклеофильные, электрофильные, свободнорадикальные реакции.
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:

В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
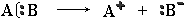
В результате образуются разноименно заряженные ионы – катион и анион.
Электрофильные реакции:молекула органического вещества подвергается действию электрофильного реагента (частицы (катиона или молекулы), имеющей свободную орбиталь на внешнем электронном уровне). Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы, NO2+, ZnCl2, AlCl3.
Электрофильное присоединение: CH2=CH2 + HCl → CH3CH2Cl (электрофил – H+ )
Электрофильное замещение: C6H6 + NO2+→ C6H5NO2 + H+ (электрофил - NO2+)
Нуклеофильные реакции:намолекулу органического вещества действует нуклеофильный реагент (частица (анион или молекула), имеющая неподеленную пару электронов на внешнем электронном уровне). Примеры нуклеофильных частиц: OH-, Cl-, H2O.
Нуклеофильное замещение: H3Cd+– Cld– + Na+OH–→ H3C–OH + Na+Cl– (нуклеофил – OH–)
Нуклеофильное присоединение: H2Cd+= Оd– + Н+CN–→ H2C(CN)–OH (нуклеофил – CN–)
3. По изменению степени окисления элементов – окислительно-восстановительные.
В органической химии окислительно-восстановительные процессы рассматриваются прежде всего по отношению к органическому веществу и связываются с изменением степени окисления углерода, являющегося реакционным центром молекулы. Эти реакции могут проходить по типу реакций присоединения, отщепления, замещения и т.п.
Часто в органической химии рассматривают реакции окисления и восстановления как реакции, связанные с потерей и приобретением атомов водорода и кислорода. Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]. Например, первичный спирт окисляется сначала до альдегида, а при дальнейшем воздействии окислителя превращается в кислоту.
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]. Например, превращение алкенов в алканы, альдегидов в первичные спирты или нитросоединений в амины.
4. По типу активации различают каталитические и некаталитические реакции.
Дата добавления: 2020-07-18; просмотров: 214;










