Характерные степени окисления
Валентные электроны Cr – 3d44s2.
Наиболее распространенными степенями окисления у Cr являются +2, +3, +6; более устойчивыми – +3 и +6 . В водных растворах степень окисления +2 устойчива в кислой, а +6 – в нейтральной, слабощелочной и слабокислой средах.
Соединения Cr (+6) проявляют сильные окислительные свойства.
Кислотно–основной характер оксидов и гидроксидов Cr закономерно изменяется в зависимости от степени окисления: в степени окисления+2 оксид и гидроксид являются основными, а в высшей степени окисления – кислотными, причем, H2CrO4 – это сильная кислота.
В водных растворах Cr(+2) в отстутсвии кислорода существует в виде аквакатионов [Cr(H2O)6]2+, которые для простоты обозначают Cr2+. Хром в высоких степенях окисления находится в растворе в форме тетраоксоанионов: CrO42– и Cr2O72–.
Природные соединения и получение металла
Элемент Сr по распространенности в земной коре достаточно распространен – содержание Cr составляет около 0,01 %, Наибольшее значение имеет минерал: хромистый железняк FeCr2O4.(рис):

Хром используют главным образом в производстве особых сортов сталей, обладающих высокой прочностью и стойкостью к удару. Хром- компонент нержавеющих и износостойких сталей и покрытий. Поэтому большое количество Cr получают не в чистом виде, а в виде феррохрома – сплава марганца и железа, содержащего от 60 до 80% Cr.
Для получения феррохрома оксидную марганцевую руду восстанавливают углем.
FeCr2O4 + 4C = Fe + 2Cr + 4CO
Вместе с оксидами Cr восстанавливаются и оксиды Fe, содержащиеся в руде.
Простое вещество
Хром – светло-серый металл. Плотность – 7,2 г/см3. Температура плавления – 1857ОС.
Хром пассивируется в концентрированных азотной и серной кислотах. При нагревании начинает с медленно взаимодействовать с разбавленными HCl, H2SO4 и HClO4 с выделением Н2:
Cr + 2H+ = Cr2+ + H2
На воздухе хром устойчив к коррозии. Он почти не окисляется на воздухе, даже в присутствии влаги.
При нагревании хром реагирует с галогенами и серой, азотом.
Соединения хрома
Соединения хрома (+6)
Все соединения Cr(+6) проявляют сильные окислительные свойства.
Оксид CrO3 – темно-красное кристаллическое вещество, гигроскопичен, сильно ядовит.
Многие органические вещества окисляются под его воздействием до СО2 и Н2О. Если стеклянную палочку смочить в CrO3 и поднести к спиртовке, она загорится.
Получают CrO3 по реакции:
K2CrO4 + 2Н2SO4(конц) = 2KHSO4 + 2CrO3 + H2O
С водой оксид CrO3 реагирует с образованием двух кислот H2CrO4 и Н2Cr2O7, известных только в растворе. В водном растворе устанавливается равновесие:
2H2CrO4  Н2Cr2O7 + H2O
Н2Cr2O7 + H2O
В щелочных растворах более устойчив CrO42–- (желтого цвета) , в интервале рН от 2 до 6 сосуществует в равновесии с Cr2O72– (оранжевого цвета) и HCrO4– ионы:
Cr2O72– + H2O  2HCrO4–
2HCrO4–  CrO42–- + 2Н+
CrO42–- + 2Н+

Хромат калия K2CrO4 – кристаллизуется в виде безводных желто-лимонных кристаллов.
Бихромат калия K2Cr2O7 – из водных растворов кристаллизуется в виде безводных оранжевых пластинок.
Бихромат аммония (NH4)2Cr2O7при нагревании до 200 оС энергично сгорают с образование тонкодисперсной окиси хрома(III).
(NH4)2Сr2O7 = Cr2O3 + 4 H2O + N2
Бихроматы и хроматы являются сильными окислителями
Сr2O72– + 14H+ +6e– = 2Cr3++ 7H2O; (E0= +1,33 В).
CrO42–+ 4H2O +3e– = Cr(OH)3 + 5OН–; (E0= +0,13 В).
Пероксохроматы
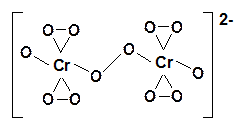
При взаимодействии соединений Сr(VI) с перекисью водорода в зависимости от условий проведения реакции можно получать различные пероксохроматы: красные [CrO8]3– и синие [Cr2O12]2–.
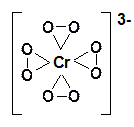
Красный пероксохромат калия K3CrO8 получают при взаимодействии 30% -ной перекиси водорода на сильнощелочной раствор хромата калия.
Синий пероксохромат калия K2Cr2O12 получают при взаимодействии 30% -ной перекиси водорода на раствор бихромата калия, охлажденному до 0oC.
Синяя перекись хрома CrO5 известна в растворах:

В водном растворе при обычной температуре пероксохроматы неустойчивы и разлагаются с выделением кислорода.
Соединения хрома (+3)
Оксид Cr2O3 –наиболее устойчивое соединение Cr(III). Оксид Cr2O3 – зеленый порошок, нерастворимый в воде. Прокаленная окись хрома(III) с большим трудом растворяется в кислотах.
Гидрат окиси хрома Cr(OН)3• nH2Oрастворяется и в растворах кислот и в растворах щелочей:
Cr(OH)3 + 3NaOН=2 Na3[Cr(OH)6]
Cr(OH)3 + 3НCl=CrCl3 + 3H2O
Хромовые квасцы KCr(SO4)2•12H2Oкристаллизуются из смешанного раствора сульфата хрома и сульфата калия, по составу и кристаллической структуре полностью соответствуют алюмокалиевым квасцамKAl(SO4)2•12H2O.
Безводный хлорид хрома CrСl3 – блестящие листочки красно-фиолетового цвета.
Ярко выраженная способность трехвалентного хрома к образованию комплексных соединений особенно отчетливо проявляется в комплексных продуктах присоединения аммиака, например [Cr(NH3)6]3+.
Соединения хрома (+2)
В водных растворах соединения Cr(+2) сильные и быстродействующие восстановители.
Водные растворы Cr(II) используют в качестве поглотителей кислорода:
2CrCl2 + 2HCl + 1/2O2 = 2CrCl3 + H2O
Cr + I2 = CrI2
| <== предыдущая лекция | | | следующая лекция ==> |
| Мотивы самосохранительного поведения | | | Мероприятия по укреплению обороноспособности государства. Вооружённые силы Советского Союза |
Дата добавления: 2020-07-18; просмотров: 371;










