ХИМИЧЕСКАЯ КИНЕТИКА. Скорость реакции
Химическая кинетика изучает скорость и механизм протекания химических реакций.
Различают два типа химических реакций: гомогенные и гетерогенные.
К гомогеннымотносятся реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе. Взаимодействие веществ в таких реакциях происходит по всему объёму.
К гетерогеннымреакциям относят реакции, протекающие на границе раздела фаз.
Пусть протекает реакция
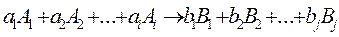 (1.1)
(1.1)
где a1, a2, ai, b1, b2, bj – стехиометрические коэффициенты.
Скорость реакции по i – му веществу в гомогенной системе определяется как количество i- го вещества, образующееся в единице реакционного объёма в единицу времени:
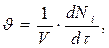 (1.2)
(1.2)
где V – объём реакционной зоны; Ni – количество i – го вещества.
Если реакция протекает изохорически, то поскольку концентрация и объём связаны соотношением
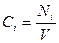
получим
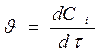 . (1.3)
. (1.3)
Размерность скорости: моль/(л·с).
Экспериментально установлено, что скорость реакции зависит от природы реагирующих веществ, их концентрации или давления, температуры, т.е.
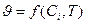 .
.
Раскрытие этой зависимости и составляет одну из задач кинетики.
Дата добавления: 2020-07-18; просмотров: 171;










