Теории металлической связи
Вещества с металлическими связями - металлы - обладают рядом особых свойств. К ним относятся высокие тепло- и электропроводность, сплошной спектр поглощения света, а также высокая пластичность многих металлов и образование между ними соединений, не отвечающих валентностям. Эти свойства говорят о том, что металлическая связь делокализована, имеет множество близко расположенных электронных состояний и ненаправленна. Некоторые из этих свойств были описаны моделью свободных электронов и методом МО.
Модель свободных электронов.В этой модели металл представляется как совокупность катионов, образующих остов, как бы погруженных в электронную жидкость, частицы которой (электроны) свободно перемещаются между катионами. Энергия связи определяется как кулоновское взаимодействие между катионами и электронами. Эта теория хорошо описывает свойства щелочных металлов. В частности, структура металлов определяется тем, что минимум энергии системы достигается при плотнейшей упаковке катионов, что имеет место при координационных числах 8 и 12; при этом связь оказывается ненаправленной, так как изменения в геометрии расположения атомов и даже изменения координационного числа в указанных пределах мало изменяют энергию связей. Эта модель, однако, плохо объясняет свойства других металлов и спектры металлов.
Теория молекулярных орбиталей (МО) для металлов.Теория МО для металлов объясняет все их свойства. В этой теории кристалл металла рассматривается как гигантская молекула из N атомов, в которой все атомы взаимодействуют друг с другом (а не только соседние). В этом случае МО будут охватывать весь кристалл. Сами МО образуются путем линейной комбинации АО всех N атомов:
 .
.
При этом из N АО образуются N МО. Расчетным и экспериментальным путем (по спектрам) показано, что разница в энергиях (DЕ) между самой нижней и самой высокой Y составляет величину порядка обычной химической связи (несколько сотен кДж/моль). Тогда расстояние между соседними МО будет очень малой величиной порядка 10-18 Дж/моль (  ) (рис. 3.26).
) (рис. 3.26).
Если взять, например, N атомов Li, имеющих по одному валентному электрону на одной атомной орбитали (2s1), то при их взаимодействии образуется столько же МО. Так как на каждой МО может быть 2ē, то лишь половина МО будет занята. Расстояние между соседними МО - dЕ - чрезвычайно мало, поэтому поглощение любого кванта энергии (даже тепловой или энергии внешнего поля) вызывает возбуждение электрона; это объясняет сплошной спектр и высокую подвижность электронов.
В случае металлов с полностью заполненными подуровнями (Ве: 2s22р0) имеет место перекрывание зон 2s-и 2р-МО и картина, показанная на рис 3.26, сохраняет свой вид (близкое расположение пустых и заполненных мест), так как обычно соседние пустая и заполненная зоны перекрываются (2s2р).
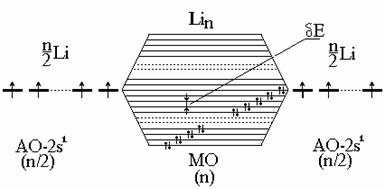
Рис. 4.26. Образование почти сплошной зоны МО в металлах
В случае металлов с незаполненными d-подоболочками d-d-взаимодействие приводит к образованию локализованных и направленных ковалентных МО. Этим объясняются высокая твердость и высокие температуры плавления таких металлов. Аналогичная ситуация и в случае f-металлов.
Таким образом, молекулярные орбитали металла образуют почти непрерывную зону разрешенных энергий (этим, в частности, объясняется непрерывный, а не линейчатый, как у атомов, или полосатый, как у молекул, спектр поглощения металлов). Разность между верхней и нижней энергиями (DЕ) зоны называется шириной зоны. Зона, заполненная электронами, называется валентной.Зона, свободная от электронов и находящаяся выше валентной зоны, - зона проводимости. Они могут либо перекрываться, либо не перекрываться друг с другом. Если эти зоны не перекрываются, то между ними существует запрещенная зона с шириной DЕ.
Ширина запрещенной зоны определяет тип кристалла: металл, полупроводник или диэлектрик (рис. 4.27).























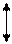



 Е
Е



 DЕ
DЕ

 DЕ
DЕ
 | |||||
 | |||||
 | |||||
 | |||||
 | |||||
 | |||||
 |
 а б в
а б в
Рис. 4.27. Зонная структура металлов (а), полупроводников (б)
и диэлектриков (в)
(верхняя зона – зона проводимости, нижняя – валентная зона)
Теория, с помощью которой объясняют свойства кристаллов, получила название зонной теории. При ширине запрещенной зоны ниже
4 эВ кристаллические вещества проявляют полупроводниковые свойства. При поглощении энергии электроны валентной зоны возбуждаются и переходят в зону проводимости, а в валентной зоне появляются вакансии электронов, которые имеют эффективный положительный заряд; их называют дырками. Наличие подвижных электронов и дырок обеспечивает собственную проводимость полупроводников. Собственную проводимость имеют, например, кремний и германий.
У диэлектриков ширина запрещенной зоны превышает 4 эВ. Для возбуждения электронов требуется очень значительная энергия, нагреванием такого возбуждения достичь невозможно, так как при этом кристалл либо расплавится, либо разрушится.
К диэлектрикам относятся многие вещества с ионными и молекулярными кристаллами, а также некоторые вещества с ковалентными кристаллами, например алмаз (DЕ = 5,1 эВ) и кварц (DЕ = 5,2 эВ).
4.8. Кристаллические решетки
Если вещество образует молекулы, полярные или неполярные, то его кристаллы обычно построены из молекул, т.е. имеют молекулярную решетку.Силы, действующие между молекулами, сравнительно слабые. Поэтому вещества с молекулярной решеткой имеют малую твердость, низкие температуры плавления, плохую растворимость в воде. При обычных условиях это, как правило, газы или жидкости.
Среди простых веществ их всего 9: Н2, N2, О2, F2, Cl2, Br2, I2, Р4 и S8.
Среди сложных веществ это большинство органических веществ, которые находятся при обычных условиях в твердом состоянии.
Из неорганических соединений это - твердый СО2 (сухой лед), вода (лед), твердые галогеноводороды и многие другие.
Для молекулярных веществ характерна следующая закономерность: вещества с большей молекулярной массой имеют более высокие температуры плавления и кипения.
Вещества с ионным типом связи часто образуют ионные решетки. Это, как правило, ионные проводники, растворяющиеся в полярных растворителях. Они тугоплавки, малолетучи, сравнительно прочны.
Если вещество не является ионным, но и не образует молекул, все связи оказываются одинаково прочными. Образуется атомная кристаллическая решетка. Вещества с атомной решеткой имеют высокие температуры плавления, высокую прочность и твердость. Они практически нерастворимы в воде и других жидкостях. Атомная решетка характерна для бора, углерода, кремния, германия, некоторых соединений этих элементов с другими (BN, SiO2 и др.).
Водородные связи
Давно было замечено, что простейшие соединения водорода с легкими электроотрицательными элементами, например фтором или кислородом, отличаются от аналогичных соединений с тяжелыми элементами аномально высокими температурами кипения и плавления. На рисунке 3.28 приведены кривые зависимости температур кипения простых водородных соединений р-элементов V-VII групп от номера периода.

Рис. 4.28. Зависимость температуры плавления (а) и кипения (б)
водородных соединений р-элементов V, VI и VII групп от № периода
Видно, что для них наблюдается последовательное повышение температуры кипения с ростом номера периода, но из нее заметно выпадают вода, фтороводород и аммиак. Экстраполяция температуры на графике дает tкип воды около -80оС. То же происходит с теплотой плавления и испарения. Объяснение этим и другим фактам было дано русскими химиками Ильинским и Бекетовым в 80-х годах XIX века. Они предположили, что между молекулами таких соединений существует особая, водородная, связь. Ее образование объясняется особыми свойствами атома водорода: катион Н+, в отличие от других катионов, является элементарной частицей с резко отличающимися размерами (меньше обычных атомов в 105 раз) и высокой подвижностью.
Поэтому он может осуществлять связь между соседними атомами, если они несут на себе отрицательные заряды. Характер связи при этом близок к ионному. А так как Rэ->> Rн+  , то угол связи ЭНЭ равен 1800.
, то угол связи ЭНЭ равен 1800.
+d -d +d -d +d -d
H ¾ F¼¼H ¾ F¼¼H ¾ F
Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты. Последние могут иметь линейное, разветвленное или кольцевое строение. Ассоциация приводит к повышению температуры кипения, температуры плавления и теплоты парообразования, изменению растворяющей способности и т.д. Энергия водородной связи меньше, чем обычных ковалентных и ионных связей (обычно менее 40 кДж/моль). Она тем больше, чем больше электроотрицательность элемента, Так, энергия водородной связи Н...F составляет около 40, связи Н....О - 20, Н...N - 8 кДж/моль. Обозначается такая связь обычно пунктиром.
Все рассмотренные примеры относятся к межмолекулярным водородным связям. Нередко водородные связи объединяют части одной и той же молекулы, то есть являются внутримолекулярными. Это характерно для многих органических веществ.
Следует отметить, что внутримолекулярные водородные связи, в отличие от рассмотренных межмолекулярных, понижают температуры и теплоты кипения и плавления веществ. Так, например, орто-нитрофенол, имеющий внутримолекулярную водородную связь, плавится при 450С, а мета-нитрофенол, молекулы которого ассоциированы за счет межмолекулярной водородной связи, - при 970С.

орто-нитрофенол мета-нитрофенол
Водородные связи имеют большое значение в живой и неживой природе. Например, построение белковых молекул, особые свойства воды, формируемые с участием водородных связей, обеспечивают само существование жизни на Земле.
Дата добавления: 2016-07-05; просмотров: 1315;










