Количественные законы электролиза
Лекция Электролиз
Если электрический ток может вырабатываться за счет химических реакций, то и за счет внешнего источника электрической энергии эти реакции могут быть проведены.
Окислительно-восстановительные процессы, протекающие на электродах при пропускании электрического тока через раствор или расплав электролита, называются электролизом.При этом на катоде происходит процесс восстановления, а на аноде - процесс окисления.
При электролизе могут быть использованы два типа анодных электродов: активные (расходуемые) и инертные (нерасходуемые). Активный анод окисляется, переходя в раствор в виде ионов, а инертный является только электродом, через который в раствор (или расплав) передаются электроны. Инертные электроды обычно изготовляют из графита или платины.
Рассмотрим, например, электролиз расплава соли CdCl2. При плавлении происходит электролитическая диссоциация соли:
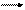 CdCl2 Cd2+ + 2Cl- .
CdCl2 Cd2+ + 2Cl- .
Если теперь в сосуд, содержащий это вещество, опустить два инертных электрода из графита и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов (рис. 7.4). При этом на катоде будет происходить восстановление ионов кадмия, а на аноде - окисление ионов хлора:
(К) - + (А)





 катод: Cd2+ + 2ē = Cd0 ;
катод: Cd2+ + 2ē = Cd0 ;
+
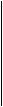 анод: 2Cl- - 2ē = Cl2 .
анод: 2Cl- - 2ē = Cl2 .
 | |||||||
 | |||||||
 | |||||||
 | |||||||




 Cd2+ Cd2+ + 2Cl- = Cd0 + Cl2
Cd2+ Cd2+ + 2Cl- = Cd0 + Cl2

 токообразующая реакция
токообразующая реакция
Cl-
 |
Cграфит
Рис.7.4. Электролиз раствора
(расплава) CdCl2
Через короткое время на инертных электродах осядут металлический кадмий и газообразный хлор (в виде пузырьков) и инертные электроды превратятся в активные - в кадмиевый и хлорный, соответственно, имеющие следующие стандартные электродные потенциалы:
Cd2+ + 2ē = Cd0 ; j0 = -0,4 В,
Cl2 .+ 2ē = 2Cl- ; j0 = +1,36 В.
Возникшему гальваническому элементу будет соответствовать токообразующая реакция, обратная электролизу:
Сd + Cl2 = CdCl2 .
Как видно из величин и знаков этих потенциалов, возникшая ЭДС направлена навстречу внешнему источнику напряжения при электролизе. Следовательно, минимальное напряжение (напряжение разложения), которое необходимо приложить для электролиза, определяется ЭДС гальванического элемента (ГЭ), возникающего в этом процессе. В данном случае
ЭДС0 = 1,36 - (-0,4) = 1,76 В.
Эта величина, однако, найдена для стандартных условий, которые часто не выполняются (нарушаются) при электролизе. Отклонение напряжения электролиза (и ЭДС ГЭ) от стандартного значения называется поляризацией. Имеется несколько причин поляризации электродов:
концентрационная поляризация - изменение концентрации ионов у электрода в результате протекания реакции (тока);
катодноеи анодное перенапряжение - замедленное протекание реакций на электродах;
пассивация электродов (образование на поверхностях труднора-створимых, плохопроводящих пленок).
Для предотвращения поляризации в растворы или электроды добавляют специальные вещества - деполяризаторы.Величина поляризации может быть порядка 0,5 В, что существенно как для электролиза, так и для ГЭ.
Последовательность электродных процессов.В рассмотренном выше примере электролиза расплава CdCl2 в электролите имелись только один вид катионов и анионов. Однако часто на практике в электролите присутствуют несколько видов ионов или недиссоциированных молекул.
В тех случаях, когда на одном и том же электроде возможно протекание двух (или большего числа) процессов, наиболее вероятен тот, осуществление которого требует меньшей затраты энергии. Это правило вытекает из законов термодинамики.
В частности, порядок разрядки ионов на электродах из смеси (раствора) при ее электролизе определяется потенциалом соответствующего электрода с учетом поляризации: первым на катоде выделяется (разряжается) тот ион, потенциал которого больше; на аноде в первую очередь разряжаются (окисляются) ионы, потенциал которых меньше.
Так как существует поляризация, то определять порядок разрядки ионов на электродах по стандартным значениям потенциалов нельзя, нужно знать экспериментальные значения потенциалов при определенных условиях. Установлено, что перенапряжение при разрядке ионов металлов на катоде наименьшее, поэтому они ведут себя при электролизе приблизительно в соответствии с их стандартными потенциалами. Наибольшее перенапряжение имеет место при разрядке сложных ионов (NO3- , SO42- и др.), а также на газовых электродах (водородном, кислородном).
В соответствии с экспериментальными данными сформулированы качественныеправила для электролиза разбавленных растворов солей, которые учитывают тот факт, что в растворе соли, кроме ее собственных ионов, имеются ионы и молекулы самой воды (Н2О. Н+, ОН-), которые также могут участвовать в электролизе.
Катодные процессы.
1. Катионы металлов, стоящих в ряду напряжений до Аl, и сам Аl не разряжаются на катоде; в этом случае на катоде восстанавливаются молекулы воды по уравнению
2Н2О + 2ē = Н2 + 2ОН-.
2. Катионы металлов, находящихся в ряду напряжений после Al до Н, разряжаются параллельно с водородом:
Zn2+ + 2е = Zn0, 2Н2О + 2е = Н2 + 2ОН- (j0 = -0,83В).
3.Ионы благородных и малоактивных металлов, потенциал которых больше, чем потенциал водородного электрода, разряжаются в первую очередь, и разряд ионов водорода или молекул воды не происходит:
Cu2+ + 2ē = Сu0.
Анодные процессы.Анионы также можно расположить в ряд по возрастанию восстановительной активности:
F- , NO3- , SO42-, OH- , Cl-, Br-, I- , S2- .
Однако, порядок разрядки также не полностью подчиняется этому ряду. Поэтому сформулированы следующие правила:
1.Простые анионы Cl-, Br-, S2- и др. (кроме F-) на аноде разряжаются сами:
2Cl- _ 2ē = Cl 2 .
2. Сложные анионы (SO42- , NO3- и т.д.) и F- на аноде не разряжаются, происходит окисление воды:
2Н2О - 4ē = O2 + 4Н+, (j0 = +1,23 В).
Пример 15. В какой последовательности будут восстанавливаться ионы металлов K+, Cu2+, Zn2+, Ag+, имеющихся в растворе при пропускании через них тока ?
Решение. Разряд катионов металлов на катоде при электролизе сопровождается присоединением электронов, следовательно, катионы металлов при этом проявляют окислительную способность. Поэтому в первую очередь будут восстанавливаться катионы металлов, имеющих больший потенциал (табл. 7.1):
1) Ag+ + ē = Ag0 (j0= +0, 8 В); 2) Cu2+ + 2ē = Cu0 (j0= +0,34 В);
3) Zn2+ + 2ē = Zn0 (j0= -0,76 В); 4) K+ + ē = K0 (j0= -2,9 В).
5) 2H2O + 2ē = H2 + 2OH- (j0 = -0,83 В).
Таким образом, в растворе последовательность восстановления следующая:
1) Ag+ + ē = Ag0, 2) Cu2+ + 2ē = Cu0 , 3) Zn2+ + 2ē = Zn0;
4) 2H2O + 2ē = H2 + 2OH-, 5) К+ + ē = К0.
Пример 16. Написать уравнения процессов, происходящих при электролизе водного раствора Na2SO4 на угольных (инертных) электродах.
Решение. Поскольку для процесса Na+ + ē = Na0 ; j0 = -2,71 В, то на катоде будет происходить восстановление воды :
2H2O + 2ē = H2 + 2OH-.
На аноде при электролизе солей функцию восстановителей выполняют кислотные остатки. Если кислотный остаток не содержит кислорода, то окисляется сам кислотный остаток, если же в состав кислотного остатка входит кислород, то легче окисляется вода по схеме: 2H2O - 4ē = O2 + 4H+.
Суммарная реакция: 6H2O = 2H2 + 4OH- + O2 + 4H+.
2H2O = 2H2 + O2 .
В этом случае соль не участвует в электродных процессах, а происходит электролиз воды. Массовая доля соли в растворе при этом увеличивается.
Такой метод получения Н2 и O2 лучше, чем электролиз чистой воды, так как добавление соли (или щелочи) приводит к увеличению электропроводности на несколько порядков, что увеличивает производительность установок.
Все вышесказанное верно для разбавленных растворов солей. В концентрированных растворах и расплавах на электродах происходит разрядка сложных анионов и активных катионов с последующими реакциями. Например, в концентрированном растворе H2SO4 на аноде:
SO42- - e = SO4- , 2SO4- ® S2О82-.
Для азотнокислых солей в концентрированных растворах и расплавах возможны реакции:
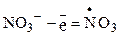 ;
; 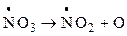 ; 2О ® О2.
; 2О ® О2.
Отметим, что электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как для расплавления необходимо нагревание до высоких Т.
Все рассмотренные выше примеры описывали процессы, происходящие при электролизе с использованием инертных электродов. Однако анод может быть активным, то есть участвовать в процессе окисления. В этом случае говорят, что протекает электролиз с растворимым анодом. При этом в качестве электролита берется соединение элемента, входящего в состав анода. На катоде и аноде происходит одна реакция в разных (противоположных) направлениях. Поэтому Dj0 = 0.
К одному из многих интересных применений этого метода относится рафинирование (очистка) металлической меди. Электролиз с растворимым анодом используется также для нанесения покрытий с целью защиты от коррозии или для декоративных целей.
Пример 17. Какие процессы будут проходить на электродах при электролизе раствора сульфата меди и хлорида кадмия в случае использования активного анода?
Решение.При прохождении электрического тока через раствор CuSO4 на катоде протекает процесс восстановления: Cu2+ + 2e = Cuo , а на аноде (Cu) - процесс окисления самого медного анода: Сuo - 2ē = Cu2+.
Таким образом, Dj0 = j0к - j0а = 0.
В растворе CdCl2 с анодом из Cd :
катод: Сd2+ +2ē = Сd ,
анод: Сd - 2ē = Сd2+
 |
токообразующая
 реакция Сd2+ + Сd Сd + Сd2+ .
реакция Сd2+ + Сd Сd + Сd2+ .
Количественные законы электролиза
Реакции электролиза являются такими же химическими реакциями, как и все остальные, т.е. по ним можно производить стехиометрические расчеты. Но для них существуют специфичные количественные соотношения, названные в честь ученого, установившего эти законы, законами Фарадея.
Таких законов два.
1. Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита:
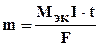 ,
,
где m - масса выделившегося или подвергшегося превращению вещества,
МЭК - эквивалентая масса вещества (г/моль экв),
I - сила тока (а), t - время (с),
F - постоянная Фарадея (96500 Кл /моль экв), т. е. количество электричества, необходимое для выделения или превращения одного моля эквивалента вещества.
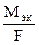 - электрохимический эквивалент.
- электрохимический эквивалент.
При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ, выделившихся на электродах, прямо пропорциональны их химическим эквивалентам.
Пример 18. Ток силой 6 А проходил в течение 1,5 часа через разбавленный раствор H2SO4. Вычислить массу разложившейся воды и объемы H2 и O2, выделившихся на электродах (00C и 760 мм рт. ст.).
Решение. В растворе кислота диссоциирует по уравнению: H2SO4 = 2Н+ + SO42-.
 |
Катод (-): 2Н+ + 2ē = Н2 х2
Анод (+): 2H2O - 4ē = O2 + 4H+. х1 ,
Токообразующая
реакция: 2H2O = 2Н2 + О2 .
Процессы электролиза подчиняются закону Фарадея (7.5):
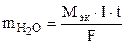 =
= 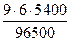 = 3,02 г.
= 3,02 г.
При вычислении объемов выделившихся газов представим уравнение в следующей форме:
V= 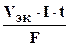 ,
,
где V - объем выделившегося газа, VЭК - его эквивалентный объем.
Поскольку при н.у. VЭК водорода равен 11,2 л/моль, а кислорода - 5,6 л/моль (см. раздел 1), то получаем:
V(H2) = 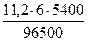 = 3,76 л, V(О2) =
= 3,76 л, V(О2) = 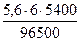 = 1,88 л.
= 1,88 л.
Пример 19.При электролизе раствора сульфата меди на аноде выделилось
350 мл кислорода (н.у.). Сколько граммов меди выделилось при этом на катоде?
Решение. CuSO4 = Cu2+ + SO42-. Согласно правилам, сформулированным выше:
 катод: Cu2+ + 2ē = Cu0, х2
катод: Cu2+ + 2ē = Cu0, х2
анод: 2H2O - 4ē = O2 + 4H+
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 .
Эквивалентный объем кислорода при н.у. составляет 5,6 л, следовательно,
350 мл составляет 0,0625 (0,35/5,6) моль эквивалентов. Значит, столько же моль эквивалентов меди выделится и на катоде (2-й закон Фарадея). Отсюда находим массу меди:
m = n·M = 0,0625·31,77 = 1,98 г (Мэк(Cu) = MCu·1/2 = 63,54/2 = 31,77 г/моль экв).
Дата добавления: 2016-07-05; просмотров: 2821;










