ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
1 Сильные и слабые электролиты
Электролитами называются такие вещества, в которых перенос электричества в электрическом поле осуществляется с помощью заряженных частиц - ионов.
Различают проводники первого и второго рода. В проводниках первого рода перенос заряда осуществляется либо при помощи электронов, либо при помощи электронов и дырок. К таким проводникам относятся металлы и полупроводники. В проводниках второго рада электрическая проводимость обуславливается положительными и отрицательными ионами. Это – растворы солей, кислот, щелочей, солевые расплавы, некоторые кристаллы солей.
Процесс распада растворенного вещества на ионы называют электролитической диссоциацией. Распад на ионы происходит независимо от того, подвергается или не подвергается вещество действию электрического тока. Образование растворов электролитов происходит по двум основным механизмам:
1 Взаимодействие ионов кристалла с диполями растворителя, приводящее к разрушению кристаллической решетки и появлению в растворе сольватированных ионов;
2 Взаимодействие с растворителем вещества, состоящего из нейтральных молекул. Так, при растворении в воде газообразного хлористого водорода получается раствор сильного электролита:
HCl + H2O → H3O+ + Cl-
Образовавшиеся ионы H3O+ и Cl- вступают во взаимодействие с молекулами растворителя, образуя сольватированные ионы.
Электролиты подразделяются на сильные и слабые. К сильным относят вещества, полностью распадающиеся на ионы при растворении. Обычно это соединения, решетка которых построена из ионов (NaCl, CaCl2, CuSo4 и другие). Слабые электролиты распадаются на ионы лишь частично, например, водные растворы аммиака, многих органических кислот. Доля распавшихся молекул на ионы называется степенью диссоциации (α).
Электролитическая диссоциация слабых электролитов носит динамический характер, в растворе непрерывно происходят процессы диссоциации электролита на ионы и соединение ионов в молекулы. К процессу электролитической диссоциации слабых электролитов применим закон действия масс.
Так, если в результате диссоциации молекул бинарного электролита получается один катион и один анион, то константа диссоциации может быть выражена следующим образом:
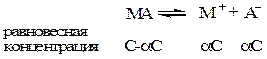
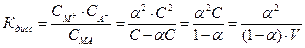
где V=1/C – разведение.
Уравнение ( ) называется законом разведения Оствальда. По теории Аррениуса константа диссоциации является постоянной для данного электролита и не зависит от концентрации. Из уравнения ( ) можно рассчитать степень диссоциации в зависимости от концентрации электролита. Решая квадратное уравнение получаем:
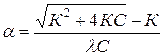
При малых константах диссоциации и при не очень низких концентрациях К2<<4КС из уравнения ( ) следует
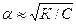
Уравнения ( ) применимы только для бинарных электролитов. Для других типов электролитов математические соотношения усложняются. Константа диссоциации (а значит и степень диссоциации) зависит от температуры. Зависимость К определяется по уравнению изобары Вант-Гоффа:
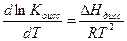
где 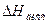 - теплота диссоциации, складывающаяся из двух эффектов: теплоты, поглощаемой при распаде молекул на ионы и теплоты гидротации (сольватации) ионов молекулами растворителя.
- теплота диссоциации, складывающаяся из двух эффектов: теплоты, поглощаемой при распаде молекул на ионы и теплоты гидротации (сольватации) ионов молекулами растворителя. 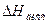 может быть больше и меньше нуля.
может быть больше и меньше нуля.
Из уравнения ( ) следует, что Кдисс может как расти (при 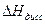 > 0), так и убывать (при
> 0), так и убывать (при 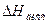 < 0) с ростом температуры.
< 0) с ростом температуры.
1 ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ
2.1 Удельная электрическая проводимость
Электрическая проводимость – способность веществ проводить электрический ток под действием внешнего электрического поля – величина, обратная электрическому сопротивлению L = 1/R
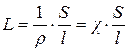 [См]
[См]
где ρ – удельное сопротивление, Ом·м; 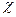 - удельная электрическая проводимость, См/м (сименс/метр); S – поперечное сечение, м2; l – длина проводника, м.
- удельная электрическая проводимость, См/м (сименс/метр); S – поперечное сечение, м2; l – длина проводника, м.
Единица измерения L – сименс (См), 1 См = 1 Ом-1
Удельная электрическая проводимость раствора характеризует проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга. Единица измерения в системе СИ См·м-1.
Удельная проводимость раствора электролита определяется количеством ионов, переносящих электричество и скоростью их миграции:
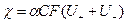
где α – степень диссоциации электролита; С – молярная концентрация эквивалента, моль/м3 или моль/л; F – число Фарадея, 96485 Кл/г-экв; 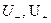 - абсолютные скорости движения катиона и аниона – скорости при градиенте потенциала поля, равном 1, В/м;
- абсолютные скорости движения катиона и аниона – скорости при градиенте потенциала поля, равном 1, В/м;
Единица измерения χ - м2В-1с-1.
Из уравнения ( ) следует, что 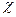 зависит от концентрации как для сильных так и для слабых электролитов (рисунок ):
зависит от концентрации как для сильных так и для слабых электролитов (рисунок ):

Рисунок 2.1 – Зависимость удельной электрической проводимости от концентрации в водных растворах.
В разбавленных растворах при С → 0 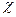 стремится к удельной электропроводности воды, которая составляет около 10-6 См/м и обусловлена присутствием ионов Н3О+ и ОН-. С ростом концентрации электролита,
стремится к удельной электропроводности воды, которая составляет около 10-6 См/м и обусловлена присутствием ионов Н3О+ и ОН-. С ростом концентрации электролита, 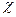 вначале увеличивается, что отвечает увеличению числа ионов в растворе. Однако, чем больше ионов в растворе, тем сильнее проявляется ионное взаимодействие, приводящее к уменьшению скорости движения ионов. Кроме того, у слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, количество ионов, переносящих электричество. Поэтому почти всегда зависимость удельной электрической проводимости от концентрации электролита проходит через максимум.
вначале увеличивается, что отвечает увеличению числа ионов в растворе. Однако, чем больше ионов в растворе, тем сильнее проявляется ионное взаимодействие, приводящее к уменьшению скорости движения ионов. Кроме того, у слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, количество ионов, переносящих электричество. Поэтому почти всегда зависимость удельной электрической проводимости от концентрации электролита проходит через максимум.
2.2 Молярная и эквивалентная электрические проводимости
Чтобы выделить эффекты ионного взаимодействия, удельную электрическую проводимость 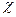 делят на молярную концентрацию С (моль/м3), и получают молярную электрическую проводимость
делят на молярную концентрацию С (моль/м3), и получают молярную электрическую проводимость 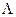 , или делят на молярную концентрацию эквивалента и получают эквивалентную проводимость
, или делят на молярную концентрацию эквивалента и получают эквивалентную проводимость 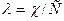 .
.
Единицей измерения 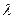 является м2См/моль. Физический смысл
является м2См/моль. Физический смысл 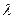 состоит в следующем: она численно равна электрической проводимости раствора, заключенного между двумя параллельными электродами, расположенными на расстоянии 1 м и имеющими такую площадь, что объем раствора между электродами содержит один моль эквивалента растворенного вещества (в случае молярной электрической проводимости – один моль растворенного вещества). Таким образом, в случае эквивалентной электрической проводимости в этом объеме будет NА положительных и NА отрицательных зарядов для раствора любого электролита при условии его полной диссоциации (NА – число Авагадро). Поэтому, если бы ионы не взаимодействовали друг с другом, то
состоит в следующем: она численно равна электрической проводимости раствора, заключенного между двумя параллельными электродами, расположенными на расстоянии 1 м и имеющими такую площадь, что объем раствора между электродами содержит один моль эквивалента растворенного вещества (в случае молярной электрической проводимости – один моль растворенного вещества). Таким образом, в случае эквивалентной электрической проводимости в этом объеме будет NА положительных и NА отрицательных зарядов для раствора любого электролита при условии его полной диссоциации (NА – число Авагадро). Поэтому, если бы ионы не взаимодействовали друг с другом, то 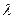 сохранялась бы постоянной при всех концентрациях. В реальных системах
сохранялась бы постоянной при всех концентрациях. В реальных системах 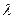 зависит от концентрации (рисунок 2.2). При С → 0,
зависит от концентрации (рисунок 2.2). При С → 0, 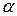 → 1, величина
→ 1, величина 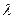 стремится к
стремится к 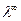 , отвечающей отсутствию ионного взаимодействия. Из уравнения (5) следует:
, отвечающей отсутствию ионного взаимодействия. Из уравнения (5) следует:
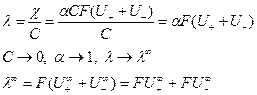
Произведение 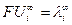 называют предельной эквивалентной электрической проводимостью ионов, или предельной подвижностью ионов:
называют предельной эквивалентной электрической проводимостью ионов, или предельной подвижностью ионов:
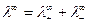 (8)
(8)
Соотношение (8) установлено Кольраушем и называется законом независимого движения ионов. Предельная подвижность является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры. Уравнение (8) для молярной электрической проводимости принимает вид:
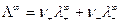
где 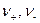 - число эквивалентов катионов и анионов, необходимых для образования 1 моль соли.
- число эквивалентов катионов и анионов, необходимых для образования 1 моль соли.
Пример: 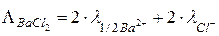
В случае одновалентного электролита, например, HCl, 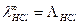 , то есть молярная и эквивалентная электрические проводимости совпадают.
, то есть молярная и эквивалентная электрические проводимости совпадают.
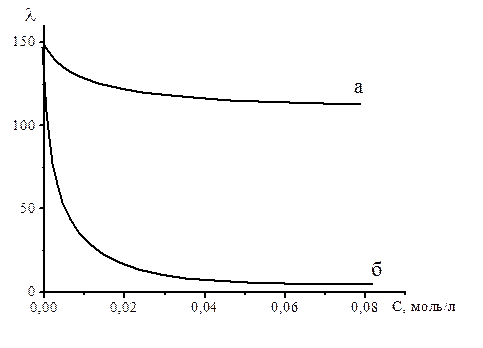
Рисунок 2.2 – Зависимость эквивалентной электропроводности от концентрации для сильных (а) и слабых (б) электролитов.
Для растворов слабых электролитов эквивалентная электрическая проводимость остается небольшой вплоть до очень низких концентраций, по достижении которых она резко поднимается до значений, сравнимых с  сильных электролитов. Это происходит за счет увеличения степени диссоциации, которая, согласно классической теории электролитической диссоциации, растет с разбавлением и в пределе стремится к 1.
сильных электролитов. Это происходит за счет увеличения степени диссоциации, которая, согласно классической теории электролитической диссоциации, растет с разбавлением и в пределе стремится к 1.
Степень диссоциации можно выразить, разделив уравнение (6) на (7):
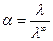
С увеличением концентрации 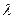 растворов сильных электролитов уменьшается, но незначительно. Кольрауш показал, что
растворов сильных электролитов уменьшается, но незначительно. Кольрауш показал, что 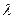 таких растворов при невысоких концентрациях подчиняется уравнению:
таких растворов при невысоких концентрациях подчиняется уравнению:
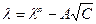
где А – постоянная, зависящая от природы растворителя, температуры и валентного типа электролита.
По теории Дебая – Онзагера снижение эквивалентной электрической проводимости растворов сильных электролитов связано с уменьшением скоростей движения ионов за счет двух эффектов торможения движения ионов, возникающих из-за электростатистического взаимодействия между ионом и его ионной атмосферой. Каждый ион стремится окружить себя ионами противоположного заряда. Облако заряда называют ионной атмосферой, и в среднем оно сферически симметрично. Первый эффект – эффект электрофоретического торможения. При наложении электрического поля ион движется в одну сторону, а его ионная атмосфера – в противоположную. Но с ионной атмосферой за счет гидратации ионов атмосферы увлекается часть растворителя, и центральный ион при движении встречает поток растворителя, движущегося в противоположном направлении, что создает дополнительное вязкостное торможение иона.
Второй эффект – релаксационного торможения. При движении иона во внешнем поле атмосфера должна исчезать позади иона и образовываться впереди него. Оба эти процесса происходят не мгновенно. Поэтому впереди иона количество ионов противоположного знака меньше, чем позади, то есть облако становится несимметричным, центр заряда атмосферы смещается назад, и поскольку заряды иона и атмосферы противоположны, движение иона замедляется. Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита при прочих постоянных условиях эти силы возрастают с увеличением концентрации раствора.
Определение растворимости труднорастворимой соли
По величине удельной электрической проводимости насыщенного раствора труднорастворимой соли можно найти ее концентрацию, а следовательно, вычислить растворимость и произведение растворимости. Поскольку в насыщенном растворе такой соли концентрация очень мала, его эквивалентная электрическая проводимость совпадает с 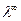 тогда из уравнения (6) получаем:
тогда из уравнения (6) получаем:
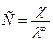
Ввиду малой удельной электрической проводимости раствора необходимо вводить поправку на 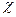 воды, поэтому:
воды, поэтому:
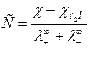
Если электролит одновалентный, то произведение растворимости, равное произведению активностей ионов в насыщенном растворе, будет равно (с некоторым приближением):
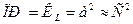
Для более сложных электролитов произведение растворимости находится аналогично, но с учетом диссоциации электролита.
Так для соли Ag2S с молярной концентрацией С (моль/л):
Ag2S  2Ag+ + S2-
2Ag+ + S2-
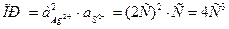
3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
Непосредственное экспериментальное измерение 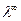 невозможно. Для растворов сильных электролитов наиболее пригоден метод экстраполяции, с использованием уравнение (10). Для этого найденные значения
невозможно. Для растворов сильных электролитов наиболее пригоден метод экстраполяции, с использованием уравнение (10). Для этого найденные значения 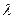 наносят на график в виде функции от
наносят на график в виде функции от 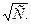 Полученная прямая экстраполируется до С = 0, и отрезок на оси ординат даст
Полученная прямая экстраполируется до С = 0, и отрезок на оси ординат даст 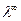 .
.
В случае слабых электролитов хорошие результаты дает способ, основанный на применении закона Кольрауша, уравнение (8), по 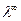 для сильных электролитов. Например, для уксусной кислоты типичного слабого электролита,
для сильных электролитов. Например, для уксусной кислоты типичного слабого электролита,
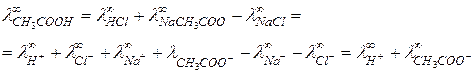
Величины 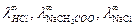 определяются методом экстраполяции.
определяются методом экстраполяции.
Кондуктометрическое титрование
Это один из физико–химических методов анализа, основанный на измерении электропроводности системы. Он с успехом применяется в случаях, когда между анализируемым раствором и титрантом могут протекать обменные ионные или окислительно – восстановительные реакции, в результате которых изменяется электропроводящая способность раствора. Зависимость электрической проводимости раствора от объема добавляемого титранта изображают графически. Полученный график называется кривой кондуктометрического титрования. Кривые имеют излом, соответствующий точке эквивалентности.
На рисунке 3.1 даны примеры кривых титрования сильной кислоты (а) и смеси слабой и сильной кислот (б) сильной щелочью. В ходе титрования объем раствора не должен значительно изменяться, для чего концентрация титранта должна быть значительно выше концентрации титруемого раствора.
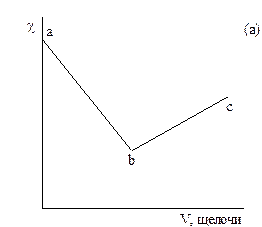
| 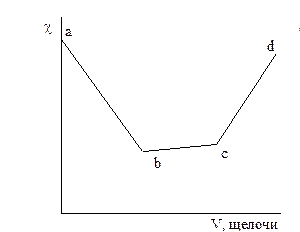
|
Рисунок 3.1 – График кондуктометрического титрования сильной кислоты (а) и смеси сильной и слабой кислот (б) сильным основанием.
Следует отметить, что подвижность ионов Н+ и ОН- является анамально высокой посравнению с другими ионами.
При титровании сильной кислоты щелочью (а) сначала происходит снижение электрической проводимости раствора за счет замены подвижного иона водорода менее подвижным катионом металла (участок ав). При добавлении к системе после точки эквивалентности избытка щелочи электрическая проводимость растет за счет появления ионов ОН- (свободной щелочи).
При титровании слабой кислоты (например, СН3СООН) щелочью (NaOH) малая электропроводность кислоты растет за счет появления свободных ионов соли (сильного электролита). После точки эквивалентности в системе появляются избыточные ионы ОН-, имеющие большую подвижность ( 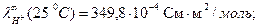
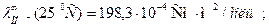
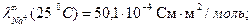
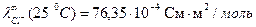 ), что приводит к резкому возрастанию электропроводности. Этому случаю отвечают линии «ав» и «сd» на рисунке 3.1 б.
), что приводит к резкому возрастанию электропроводности. Этому случаю отвечают линии «ав» и «сd» на рисунке 3.1 б.
При титровании смеси кислот сначала оттитровывается сильная кислота (участок ав), а затем начинается нейтрализация слабой, малодиссоциированной кислоты. При этом образуется хорошо диссоциированная соль, что приводит к повышению 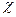 (участок вс) до точки эквивалентности (с).
(участок вс) до точки эквивалентности (с).
Дальнейшее приливание избытка щелочи приводит к более резкому возрастанию 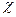 за счет ионов ОН- щелочи.
за счет ионов ОН- щелочи.
Этим методом можно проводить титрование солей, если выпадает осадок, понижающий концентрацию ионов, обусловливающих электропроводность раствора, например, при титровании MgSO4 раствором Ва(ОН)2:
MgSO4 + Ва(ОН)2  Mg(ОН)2 ↓ + Ва SO4 ↓
Mg(ОН)2 ↓ + Ва SO4 ↓
Задача 1
Константа диссоциации уксусной кислоты равна 1,8·10-5. Чему равен рН раствора, если к 1 л раствора кислоты (С = 1 моль/л) добавить 8,2·10-3 кг ацетата натрия? Считать, что объем раствора не изменится при добавлении соли.
Дано:
Кд = 1,8·10-5
Vраствора= 1 л
Скислоты = 1 моль/л
mсоли =8,2·10-3 кг
рН - ?
Решение
В системе имеется кислота, которая диссоциирует частично, и соль которая диссоциирует нацело.
СН3СООН  СН3СОО- + Н+
СН3СОО- + Н+
до реакции 1 0 0
при равновесии 1-х х х
СН3СООNa  СН3СОО- + Na+
СН3СОО- + Na+
до реакции 0,10 0 0
после дисоциации 0 0,10 0,10
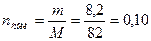 моль
моль
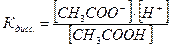
Ацетат ион, СН3СОО-, образуется за счет диссоциации как кислоты так и соли, т.е. 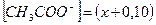
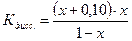
Поскольку электролит является слабым, то количество продиссоциированного электролита, х мало, и в алгебраических суммах им с небольшой погрешностью можно пренебречь. Тогда:
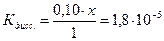
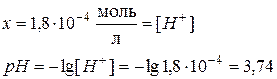
Задача 2
Предельная электрическая проводимость водного раствора NH4Cl равна 130·10-4 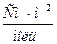 . Подвижности ионов ОН- и Cl- соответственно равны 174·10-4 и 65,4·10-4
. Подвижности ионов ОН- и Cl- соответственно равны 174·10-4 и 65,4·10-4 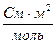 . Вычислить предельную электрическую проводимость NH4ОН и число переноса иона NH4+ в растворе NH4Cl при бесконечном разведении.
. Вычислить предельную электрическую проводимость NH4ОН и число переноса иона NH4+ в растворе NH4Cl при бесконечном разведении.
Дано

Решение:
Согласно закону Кольрауша: 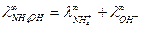 .
.
Для нахождения 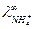 запишем закон Кольрауша для NH4Cl:
запишем закон Кольрауша для NH4Cl:
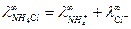 откуда
откуда 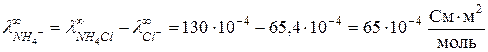 .
.
Таким образом,
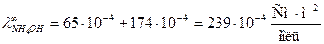
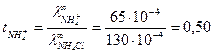
Задача 3
Определить теплоту диссоциации уксусной кислоты, если удельное сопротивление раствора кислоты с С = 0,01 моль/л, при 298 К равно 61,0 Ом·м, а при 288 К равно 83,7 83,7 Ом·м.
Дано:
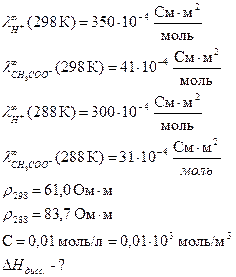
Решение:
Теплота реакции диссоциации кислоты определяется из уравнения изобары Вант Гоффа в интегральном виде:
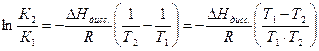
Для решения надо рассчитать константы диссоциации при двух температурах, используя уравнения:
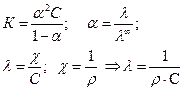
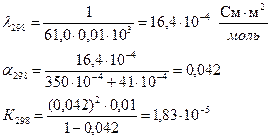
Аналогично рассчитываем для 288 К:
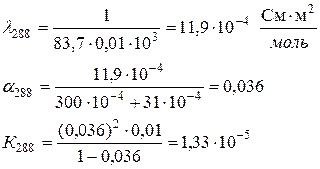
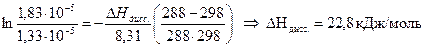
Дата добавления: 2016-06-22; просмотров: 16983;










