Последовательность разряда ионов.
I. Для процессов, протекающих на катоде:
1. При электролизе растворов солей металлов, расположенных в ряду напряжений после Н2 ( 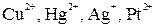 ) на катоде выделяется соответствующий металл по схеме:
) на катоде выделяется соответствующий металл по схеме:
 .
.
2. При электролизе растворов солей металлов, которые находятся в начале ряда напряжений (  ), на катоде разряжаются ионы водорода из воды;
), на катоде разряжаются ионы водорода из воды;
3. при электролизе растворов солей металлов, электронные потенциалы которых находятся между потенциалами  (
(  до Н), на катоде выделяется металл и Н2:
до Н), на катоде выделяется металл и Н2:
 ;
;
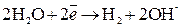 .
.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения величины стандартного электродного потенциала соответствующего металла. Так, из смеси катионов  сначала будут восстанавливаться катионы серебра
сначала будут восстанавливаться катионы серебра  затем катионы меди
затем катионы меди  и последними – катионы железа
и последними – катионы железа  .
.
Вывод. При разрядке ионов на катоде легче разряжаются те из них, которым отвечает наибольшее значение положительного потенциала.
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Обычно аноды подразделяются на нерастворимые и растворимые. Первые изготавливаются из угля, графита, платины, иридия; вторые – из меди, серебра, цинка, кадмия, никеля и других металлов.
II. Для процессов, протекающих на нерастворимом аноде.
1) При электролизе водных растворов бескислородных кислот и их солей, кроме 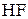 и фторидов, будут окисляться данные анионы. Например, при электролизе (
и фторидов, будут окисляться данные анионы. Например, при электролизе (  и их солей на аноде выделяется
и их солей на аноде выделяется  )
)
 (галоген)
(галоген)
2) При электролизе кислородсодержащих кислот и их солей (  и т. д.) на аноде выделяется О2, так как анодное окисление претерпевают ионы или вода, но потенциал окисления воды значительно меньше, чем для данных анионов.
и т. д.) на аноде выделяется О2, так как анодное окисление претерпевают ионы или вода, но потенциал окисления воды значительно меньше, чем для данных анионов.
Например,
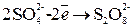
 В
В

 В
В
Вывод. В целом, на аноде происходят в первую очередь те процессы, потенциалы которых более отрицательны, то есть меньше по величине.
Растворимый анод при электролизе сам подвергается окислению, т. е. посылает электроны во внешнюю цепь.
Пример. Два медных электрода помещены в раствор 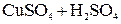 .
.
Рассмотрим электродные процессы при прохождении электрического тока:
На катоде – восстановление катионов меди:
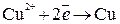 .
.
На аноде – окисление меди:
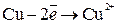 .
.
Происходит растворение анода:

металл уходит уходят во
анода в раствор внешнюю цепь
и анод растворяется. Этот случай электролиза широко используется для очистки металлов.
Дата добавления: 2020-03-21; просмотров: 454;










