Задачи для самостоятельного решения
1. Во сколько раз следует увеличить концентрацию водорода в системе
 ,
,
чтобы скорость реакции возросла в 125 раз?
2. Как изменится скорость реакции
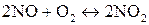
если давление в системе увеличить в два раза?
3.Реакция между оксидом азота (II) и хлором протекает по уравнению
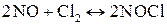 ;
;
как изменится скорость реакции при увеличении:
а) концентрации оксида азота в два раза;
б) концентрации хлора в два раза;
в) концентрации обоих веществ в два раза?
4. При 150˚С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент равным 2,5, рассчитайте, через какой период времени закончится эта реакция при 80˚С.
5. При температуре 40˚С реакция протекает за 36 минут, а при 60˚С – за 4 минуты. Рассчитайте температурный коэффициент скорости реакции.
6. Скорость некоторой реакции при 1000С равна 1. Во сколько раз медленнее будет протекать та же реакция при 100С (температурный коэффициент скорости принять равным 2)?
7. При охлаждении реакционной смеси с 500 до 200С скорость химической реакции уменьшилась в 27 раз. Вычислите температурный коэффициент этой реакции.
8. Составьте математическое выражение константы химического равновесия для каждой из следующих реакций:
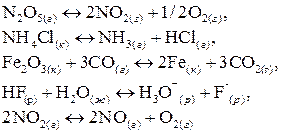
Выполняя это задание, особо обратите внимание на то, что некоторые вещества – участники реакций – находятся в твердом состоянии.
9. Вычислить константу равновесия реакции
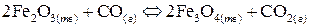
если равновесные концентрации равны
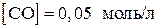 ,
, 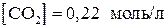 .
.
10. Примените принцип Ле Шателье для предсказания условий, которые позволяют увеличить выход нижеприведенных реакций за счет смещения равновесия:
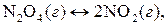 (ΔН>0);
(ΔН>0);
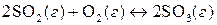 , (ΔН<0);
, (ΔН<0);
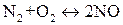 , (ΔН<0).
, (ΔН<0).
11. Среди приведенных реакций укажите те, для которых повышение давления смещает вправо химическое равновесие:
а)  ;
;
б)  ;
;
в) 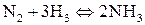 ;
;
г) 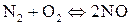 ;
;
д) 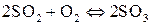 ;
;
е) 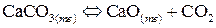 .
.
12. При некоторой температуре константа равновесия процесса
 равна 1.
равна 1.
Начальные концентрации Н2 и НСОН составляли 4 моль/л и 3 моль/л соответственно. Какова равновесная концентрация СН3ОН?
13. Реакция протекает по уравнению 2А ↔ В. Исходная концентрация вещества А равна 0,2 моль/л. Константа равновесия реакции равна 0,5. Вычислите равновесные концентрации реагирующих веществ.
14. При некоторой температуре равновесная концентрация серного ангидрида, образующегося в результате реакции
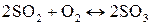 ,
,
составила 0,02 моль/л. Исходные концентрации сернистого газа и кислорода составляли, соответственно, 0,06 и 0,07 моль/л. Рассчитайте константу равновесия реакции.
Дата добавления: 2020-03-21; просмотров: 357;










