Физические представления о горении топлив
Процесс горения и его расчет.Горение сопровождается смесеобразованием, диффузией, воспламенением, теплообменом и другими процессами, протекающими в условиях тесной взаимосвязи. Поэтому организация процесса горения в топочных устройствах требует изучения не только свойств топлив и кинетики реакций горения, но и особенностей всех физических процессов при горении.
Детонация - быстро приближающийся к взрыву процесс горения горючей смеси в цилиндре карбюраторного двигателя, при котором резко (в сто раз) увеличивается скорость распространения пламени.
Горение - химический процесс соединения топлива с окислителем, сопровождающийся интенсивным тепловыделением и резким повышением температуры продуктов сгорания.
Различают гомогенное и гетерогенное горение. При гомогенном горении тепло- и массообмен идут между веществами, находящимися в одинаковом агрегатном состоянии (обычно газообразном).
Гетерогенное горение свойственно жидкому и твердому топливам.
Кинетика реакций горения. Скорость химической реакции зависит от концентрации реагирующих веществ, температуры и давления и определяется произведением концентраций реагирующих веществ
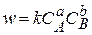 ,
,
где k - константа скорости реакции; СА и CВ - концентрации реагирующих веществ.
Скорость реакции при росте температуры существенно увеличивается, что определяется законом Аррениуса
k =koe-E/(RpT) , (4)
где ko - эмпирическая константа.
Энергия активации Е - наименьшая энергия (для газовых смесей 85 - 170 МДж/кмоль), которой должны обладать молекулы в момент столкновения, чтобы быть способными к химическому взаимодействию. Разность энергий активации прямой и обратной реакции составляет тепловой эффект химической реакции.
Реакции характеризуются сильной экзотермичностью, обусловливающей рост температуры. Влияние температуры на скорость реакции значительно сильнее влияния концентрации реагирующих веществ. Поэтому, несмотря на уменьшение концентрации реагирующих веществ при горении, скорость реакции горения увеличивается и достигает максимума после выгорания 80 - 90% горючих веществ. Реакции горения газообразного топлива протекают практически мгновенно, что объясняется не только сильным влиянием температуры, но и цепным характером их протекания.
Скорость реакции зависит также от давления: w~pn-1 (n - порядок реакции).
Процесс горения топлива имеет две области: кинетическую, в которой скорость горения топлива определяется скоростью химической реакции, и диффузионную, в которой регулятором скорости выгорания является скорость смесеобразования. Примером кинетической области горения является горение однородной газовоздушной смеси. Диффузионно горит газообразное топливо, вводимое в реакционную камеру отдельно от окислителя.
Кинетическая область I (рис. 5.1) химического воздействия на скорость горения наиболее сильно ощущается при низких концентрациях, температурах и давлениях в смеси. В этих условиях химическая реакция может настолько замедлиться, что сама станет тормозить горение. Диффузионная область II воздействия на скорость выгорания топлива проявляется при высоких концентрациях и температурах. Химическая реакция протекает очень быстро, и задержка в горении может быть вызвана недостаточно высокой скоростью смесеобразования.
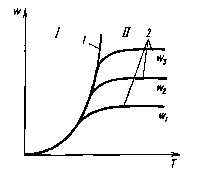
Рис. 1. Зависимость скорости горения от температуры
при разных скоростях смесеобразования (w1 < w2 < w3):
1 - химическая реакция; 2 - смесеобразование
Процесс смесеобразования практически не зависит от температуры.
Кинетическое горение готовой горючей смеси при турбулентном режиме движения очень неустойчиво. Поэтому в высокопроизводительных промышленных топочных устройствах при турбулентном режиме движения газовоздушных потоков горение является в основном диффузионным.
Процесс горения горючей смеси может начаться путем самовоспламенения или принудительного воспламенения (электрическая искра, факел и т. п.). Температура самовоспламенения определяется соотношением количеств теплоты, выделяющейся при горении и отдаваемой во внешнюю среду. Количество теплоты, выделяющейся при горении, зависит от температуры и изменяется по экспоненте 1 (рис. 2):
qв = QwV= QVk0Cne-E/(RpT) (5)
где Q - тепловой эффект реакции; w - скорость реакции; V - объем; Т - температура среды. Зависимость отвода теплоты qот от температуры Т линейная (прямые 2, рис. 5.2),
q от = aA(T-Tc), (6)
где a - коэффициент теплоотдачи; А - площадь поверхности; Тс - температура
охлаждаемой стенки.
При небольшом отводе теплоты (прямая 2"') количество выделяемой теплоты qв > qот, поэтому реакция сопровождается повышением температуры системы, приводящим к самовоспламенению.
При большем отводе теплоты (прямая 2") в точке В qв = qот. Температура ТВ в этой точке называется температурой воспламенения горючей смеси. Она зависит от условий отвода теплоты и не является физико-химической константой, характеризующей данную горячую смесь. При увеличении отвода теплоты (прямая 2') самовоспламенение невозможно. Точка А соответствует стабилизированному окислению в области низких температур, а точка Б - неустойчивому равновесию в области высоких температур.
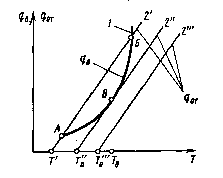
Рис.2. Условия самовоспламенения при разном отводе теплоты
Температура воспламенения может быть найдена из условий
qB = qoт и dqB/dT = dqот/dT,
определяемых точкой В (рис. 2). С учетом уравнений (5) и (6)
Тв = Тс+ RT 2в /E. (7)
Температура воспламенения Тв для некоторых газов приведена в табл. 3.
Минимальная и максимальная концентрации горючей составляющей, ниже и выше которых не происходит принудительное воспламенение смеси, называются концентрационными пределами воспламенения (табл. 2); они зависят от количества и состава негорючих составляющих газообразного топлива, повышающих нижний и понижающих верхний пределы воспламенения.
Таблица 2
| Газ | Тв, К | Концентрационные пределы воспламенения газовоздушной смеси при 293 К и 0,1 МПа, % | |
| нижний | верхний | ||
| Водород Н2 | 580-590 | 4-9 | 65-75 |
| Окись углерода СО | 645-660 | 12-15 | 71-75 |
| Метан СН4 | 650-750 | 5-6 | 12-15 |
Устойчивый непрерывный процесс горения в топочном устройстве требует стабилизации фронта воспламенения готовой (кинетическое горение) или образующейся (диффузионное горение) горючей смеси. Для этого с помощью местного торможения создаются зоны со скоростью потока, меньшей скорости распространения пламени; осуществляется непрерывное воспламенение смеси от постороннего источника; на пути потока устанавливаются плохо обтекаемые тела, обеспечивающие обратную циркуляцию продуктов сгорания, поджигающих смесь.
Горение жидкого топлива протекает в основном в парогазовой фазе, так как температура его кипения значительно ниже температуры воспламенения. Интенсивность испарения горючих веществ увеличивается с ростом поверхности контакта с воздухом и количества подводимой теплоты. Таким образом, скорость горения определяется тонкостью его распыливания. Улучшению распыливания способствует понижение вязкости, что достигается предварительным подогревом топлива до 340 - 390 К перед подачей в форсунки.
Твердое топливо претерпевает предварительную тепловую подготовку, в процессе которой происходит прогрев частиц, испарение влаги и выделение летучих веществ. Наиболее бурное выделение летучих веществ, воспламеняющихся первыми, происходит в интервале температур 470 - 720 К. Время горения их вблизи твердого остатка составляет незначительную часть общего времени горения топлива и способствует его прогреву и воспламенению. После выгорания значительной части летучих веществ начинается выгорание коксового остатка. На процесс горения твердого топлива заметно влияет зола, затрудняющая диффузию кислорода к горючему. При температуре горения, превышающей температуру плавления золы, частицы горючих веществ ошлаковываются, что еще больше затрудняет к ним доступ кислорода.
Дата добавления: 2018-11-26; просмотров: 478;










