Теория кристаллического поля
Теория основывается на представлении об ионном характере связи в комплексе типа АВк (А – красящий ион из числа d-элементов, В – лиганд, в частности, ион кислорода). Лиганды (от лат. ligo – связываю) – в химических комплексных соединениях молекулы или ионы, непосредственно связанные с центральным атомом (комплексообразователем).
Сущность модели кристаллического поля – изменение энергетического состояния d-уровней центрального иона А в электростатическом поле лигандов.
Расщепление d-уровней центрального атома кристаллическими полями различной симметрии позволяет объяснить спектральное положение полос поглощения в цветных стёклах, окрашенных ионными красителями из группы d-элементов, а также магнитные свойства стёкол с добавками оксидов титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди.
Лиганды полиэдров создают поля различной симметрии и различной напряженности, воздействующие на электроны центрального катиона: Ti, V, Cr, Mn, Fe, Co, Ni, Cu.
Теория молекулярных орбиталей
Теория рассматривает химическую связь, как результат движения электронов в суммарном поле, создаваемом всеми ядрами и электронами атомов с учётом геометрии их пространственного расположения.
Теория позволяет рассчитать энергетическое распределение орбиталей, предсказать последовательность заполнения орбит электронами, оценить эффективный заряд ионов, оценить степень ионности, кратность связи и т.д.
Ввиду математических сложностей и ограничений метода в настоящее время возможны расчёты только для отдельных фрагментов структуры, в частности для небольших координационных полиэдров типа [SiO4], [АlO6], [BO3] и др.
Зонная теория
В отличие от других теорий химической связи, рассматривающих распределение электронов между атомами, позволяет перейти от отдельных молекулярных орбиталей к зонному строению твёрдых тел. Наибольший интерес представляет строение внешних энергетических зон соединения: валентной зоны, запрещенной зоны и зоны проводимости. По особенностям строения этих зон все вещества подразделяются на металлы (а), полупроводники (б) и диэлектрики (в) (рис. 2.18, табл. 2.11).
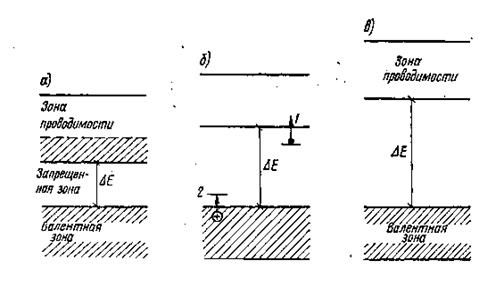
а б в
Рис. 2.18. Строение внешних зон твёрдого тела
Таблица 2.11
Свойства материала в зависимости от заполнения
зоны проводимости
| Вид материала | Наличие электронов в зоне проводимости | Электропроводность | Прозрачность в оптическом диапазоне |
| диэлектрики | отсутствуют | низкая | высокая |
| полупроводники | отсутствуют | высокая | непрозрачны в УФ и видимой области |
| проводники | имеются | высокая | непрозрачны |
Оксидные стёкла на основе силикатов, боратов, фосфатов и т.д. относятся к классу диэлектриков. Они отличаются высокими значениями энергетического барьера (большой шириной запрещенной зоны ΔЕ) между валентной зоной и зоной проводимости. Тепловой энергии и энергии излучения в оптическом диапазоне недостаточно для возбуждения электронов и их перехода из валентной зоны в зону проводимости. Сказанное объясняет высокую прозрачность оксидных стёкол, их высокие электроизоляционные свойства и низкую теплопроводность.
Дата добавления: 2018-11-26; просмотров: 470;










