Тема 4 Химическая связь
Химическая связь – это взаимное сцепление атомов в молекуле в результате перекрывания их электронных облаков. Образованию химической связи может предшествовать гибридизация АО: преобразование различающиеся по форме и энергии АО разных подуровней в такое же количество гибридных молекулярных орбиталей. Гибридные орбитали имеют одинаковую энергию и форму, что обеспечивает равноценность образующихся связей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание с орбиталями присоединяющегося атома, чем негибридизованные. В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. Тип гибридизации АО центрального атома определяет геометрическую форму образующихся молекул или ионов.
Таблица 4
Форма молекул и тип гибридизации центрального атома
| Гибридизация центрального атома | Геометрическая форма молекулы или иона | Угол между связями | Пример молекулы или иона |
| sp | Линейная | 180° | BeF2, CH≡CH, [Ag(NH3)2]+ |
| p2 | Угловая | 90° | H2S, TeCl2 |
| sp3 | Угловая | ~109,5° | H2O |
| sp2 | Плоский треугольник | 120° | BF3, CO32– |
| sp2 | Плоский прямоугольник | 120° | CH2=CH2 |
| sp3 | Тетраэдр | 109,5° | CH4, NH4+ |
| d 3s | Тетраэдр | 109,5° | TiCL4 |
| sp3 | Тригональная пирамида | ~109,5° | NH3, Н3О+, SО32– |
| sp3d | Тригональная бипирамида | 90°, 120° | PCl5, |
| sp3d2 | Октаэдр | 90° | SF6, [АlF6]33– |
| d2sp3 | Октаэдр | 90° | [Fе(СN)6]4– |
| dsp2 | Плоский квадрат | 90° | [PdСl4]2– |
Рассмотрим образование молекул с разным типом гибридизации центрального атома.
При образовании молекулы ВеF2 атом бериллия переходит в возбужденное состояние и имеет два неспаренных электрона один на 2s- и один на 2р-орбитали. Гибридизация этих АО приводит к образованию двух sp-гибридных молекулярных орбиталей, расположеных в молекуле под углом 180°, поскольку в таком случае электроны на этих орбиталях испытывают наименьшее взаимное отталкивание. В результате молекула ВF2 имеет линейное строение. Молекула неполярна. В молекуле две равноценные σ-связи Be–F, π-связей нет. Связи полярны, электронная плотность смещена к более электроотрицательному атому F. На рисунке для атомов F показаны только 2р-электроны, образующие связи.
|
| |
| |
| |
|
|
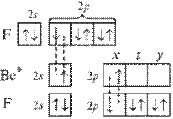

Рисунок 2 Молекула BeF: а) sp-гибридизация АО бериллия и образование двух σ-связей; б) пространственное строение молекулы
При образовании молекулы ВF3 три неспаренных электрона атома бора в возбужденном состоянии расположены на АО 2s, 2рх, 2рz. В результате гибридизации образуются три гибридные sp2-орбитали. Для достижения минимального отталкивания гибридные орбитали направлены в углы правильного треугольника, углы между орбиталями равны 120°. В результате молекула ВF3 имеет форму плоского треугольника, ядро атома бора располагается в центре. Молекула ВF3 неполярна. В молекуле три σ-связи, все связи равноценны, π-связей нет. Связи полярны, электронная плотность смещена в строну атома F.
 |
| |


Рисунок 3 Молекула ВF3: а) гибридизация АО бора и образование трех σ-связей; б) ориентация в пространстве исходных атомных 2s-, 2рx- и 2рz-орбиталей; в) ориентация в пространстве гибридных sp2-орбиталей
При образовании связей атомами C, N, О и Cl в гибридизации участвуют одна s-орбиталь и три p-орбитали, во всех случаях образуются четыре sp3-гибридные орбитали, направленные в пространстве от ядра к углам тетраэдра. Углы между орбиталями во всех случаях близки к 109°, однако форма молекул, образуемых этими атомами различны.
В молекуле метана СН4 четыре σ-связи, π-связей нет, связи полярны,электронная плотность смещена к атому С. Форма молекулы тетраэдрическая, молекула неполярна, угол между орбиталями равен 109,46°.
| |
|
| |
|
| |


Рисунок 4 Молекула СН4: а) гибридизация АО углерода и образование четырех σ-связей; б) ориентация в пространстве гибридных sp3-орбиталей
|
|
|
|



Рисунок 5 Молекула NH3: а) гибридизация АО азота, образование гибридных sp3-орбиталей и трех σ-связей; б) пространственное строение молекулы NH3 и иона NH4+
В молекуле воды Н2О на двух sp3-гибридных орбиталях кислорода располагается неподеленные пары электронов. В молекуле две σ-связи, π-связей нет. Вследствие отталкивания неподеленных электронных пар, угол между связями О–Н отклоняется от тетраэдрического и составляет 104,5°.
|
|
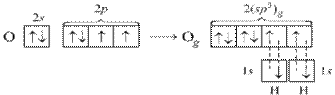

Рисунок 6 Молекула H2О: а) гибридизация АО кислорода, образование гибридных sp3-орбиталей и двух σ-связей; б) пространственное строение молекулы H2О.
При образовании комплексного иона [АlF6]33– в гибридизации участвуют вакантные 3d-орбитали алюминия и образуется шесть гибридных sp3d2-орбиталей, направленных к углам октаэдра. Форма иона октаэдрическая, число σ-связей шесть, угол между связями 90°, π-связей нет.


Рисунок 7 Образование иона [АlF6]33– и ориентация sp3d2-гибридных орбиталей
Комплекс [Fе(СN)6]4– тоже имеет октаэдрическую форму, хотя гибридизация d2sp3-типа. Гибридизация с участием d-орбиталей приводит также к квадратной и тетраэдрической формам молекул и ионов.
Тема 5 Основные понятия о химической кинетике.
Химическая кинетика изучает протекание химических процессов во времени. Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, наличия катализатора, гомогенного или гетерогенного состояния реакционной массы.
Гомогенная реакция – протекает во всем объеме, реагирующие вещества и продукты реакции находятся в одной фазе.
Скорость гомогенной химической реакции (υ) – количество вещества Dn, реагирующего или образующегося в единицу времени Dt в единице объема DV реакционного пространства
υ гомо = n/(Vτ)
υ гомо = C/τ
поскольку n/V – это молярная концентрация (С), то
скорость гомогенной реакции – изменение молярной концентрации реагирующего вещества во времени (единица измерения моль·л-1·с-1):
Мгновенная скорость реакции – изменение концентрации (dC) в конкретный момент, т.е. за бесконечно малый отрезок времени
(dt): υмгнов=dC/dt.
Гетерогенная реакция – реакция протекает на границе раздела фаз, реагирующие вещества и (или) продукты реакции находятся в разных фазах.
Скорость гетерогенной реакции зависит от поверхности соприкосновения реагентов – площади раздела фаз (S) (единица измерения моль·м-2·с-1).
Скорость гетерогенной реакции
υгетеро = n/(Sτ).
Скорость химической реакции всегда положительна, знаки «+» или «–» указывают образуется или расходуется вещество в ходе реакции.
Закон действующих масс: Скорость гомогенной реакции пропорциональна произведению молярных концентраций реагирующих веществ (А и В), взятых в степенях, равных стехиометрическим коэффициентам (а,в).
аА + bВ → сС + dD
υ = k[А]а · [В]в , где
k (коэффициент пропорциональности) – константа скорости химической реакции.
Чем больше стехиометрический коэффициент вещества в уравнении, тем больше влияет изменение его концентрации на скорость реакции.
Скорость реакции растет с ростом температуры, поскольку растет скорость молекул и число их активных соударений, приводящих к взаимодействию.
Правило Вант-Гоффа: скорость химической реакции возрастает в 2 ÷ 4 раза при увеличении температуры на 10°.
v2 = v1∙γ(t2- t1)/10, где
v1 – скорость реакции при начальной температуре t1;
v2 – скорость реакции при температуре t2
γ – температурный коэффициент, его значение обычно составляет 2 ÷ 4.
Катализатор – вещество увеличивающее скорость реакции, само не вступает во взаимодействие, в равной степени ускоряет прямую и обратную реакции, не смещает химическое равновесие, приводит к более быстрому его достижению. Количество катализатора значительно меньше, чем реагентов. Катализ гомогенный (катализатор и реагенты в одной фазе) и гетерогенный (в разных фазах).
Обратимые реакции – химические реакции, протекающие одновременно в прямом (®) и обратном () направлениях.
Химическое равновесие – состояние, в котором равны скорости прямой и обратной реакций, концентрации реагентов и продуктов постоянны.
Константа равновесия обратимой химической реакции – отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций реагентов в степени стехиометрических коэффициентов в уравнении, показывает во сколько раз скорость прямой реакции больше скорости обратной реакции.
aA + bB ⇄ сС + dD,
 для газов
для газов
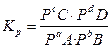 ,
,
где Р- парциальное давление.
Кравн зависит от температуры, природы реагирующих веществ, не зависит от их концентрации. При Кравн>>1 выход продуктов высокий, при Kc<<1 выход продуктов мал, преобладают исходные реагенты.
Изменение хотя бы одного параметра системы приводит к нарушению равновесия и установлению нового равновесия с другими равновесными концентрациями, т.е. смещению равновесия.
Правило Ле Шателье – правило смещения химического равновесия обратимой химической реакции: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие системы сместится в сторону той реакции, которая ослабляет это воздействие.
Пример 1Определите порядок и молекулярность прямой реакции, напишите выражение скорости реакции
а) 2H2O2 (г) = О2(г) + 2H2O (г),
б) S (тв) + O2(г) = SO2 (г).
РешениеПорядок реакции – сумма показателей степени концентраций исходных веществ в уравнении скорости реакции.
а) реакция гомогенная, выражение скорости реакции υа=kа[H2O2]2;
б) реакция гетерогенная, выражение скорости реакции υб=kб[O2].
Реакция а) – второго порядка, реакция б) – первого порядка.
Молекулярность реакции – число молекул, участвующих одновременно в акте химического взаимодействия. Обе реакции двухмолекулярные.
Пример 2Напишите выражения скорости прямой и обратной реакций по закону действующих масс. В сторону прямой или обратной реакции сместится равновесие, при увеличении давления в системе в 3 раза?
а) 2SO3 (г) ⇄ 2SO2 (г) + O2 (г),
б) FeO (тв) + CO (г) ⇄ Fe (тв) + CO2(г).
Решение
а) Реакция а) гомогенная,  υпрям1=kпрям [SO3]2; υобр1=kобр [SO2]2·[O2], где
υпрям1=kпрям [SO3]2; υобр1=kобр [SO2]2·[O2], где
υпрям1 – скорость прямой реакции
υобр1 – скорость обратной реакции
kпрям – константа скорости прямой реакции,
kобр – константа скорости обратной реакции,
[SO3], [SO2] и·[O2] – молярные концентрации реагирующих веществ.
Увеличение давления в 3 раза равноценно увеличению концентраций реагирующих веществ в 3 раза.
υпрям2=k(3[SO3])2=9k[SO3]2=9υпрям1
Скорость прямой реакции возросла в 9 раз.
υобр2=k (3 [SO2])2·(3[O2])=27k[SO2]2·[O2]= 27υобр1
Скорость обратной реакции возросла в 27 раз.

| =9 | 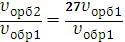
| =27 |
27:9=3 – при увеличении давления в 3 раза равновесие обратимой реакции сместилось в сторону преимущественного протекания обратной реакции.
б) Реакция б) гетерогенная.
Выражение скорости включает только газы:
υпрям1=kпрям [CO], υобр1=kорб [CO2].
Скорости при увеличении давления в 3 раза:
υпрям2=k 3[CO] – скорость прямой реакции возросла в 3 раза
υобр2=k 3 [CO2] – скорость обратной реакции также возросла в 3 раза, т.е.
при увеличении давления смещения равновесия не произошло.
Пример 3 Запишите выражение константы равновесия обратимой реакции. Как надо изменить температуру, давление, концентрацию исходных веществ, чтобы сместить равновесие в сторону прямой реакции
а) 2SO3 (г) ⇄ 2SO2 (г) + O2 (г), ΔH= 384 кДж,
б) 2CO (г) ⇄ CO2 (r) + C (тв), ΔН= -173 кДж?
Решение
Смещение равновесия подчиняется правилу Ле Шателье.
Реакция а) гомогенная, установление равновесия зависит от концентрации всех веществ.
Реакция а)эндотермическая, для смещения равновесия в сторону преимущественного протекания прямой реакции (вправо) необходимо повысить температуру.
Равновесие при понижении давления смещается в сторону образования большего числа молей газов. В прямой реакции газов образуется 2 моля, в обратной – 3 моля. Для смещения равновесия в сторону прямой реакции надо понизить давление в системе, повысить концентрацию SO3, газообразные продукты SO2 и O2 выводить из системы.
Реакция б) гетерогенная, экзотермическая,
Кр = [CO2]/[CO]2
Для смещения равновесия в сторону прямой (экзотермической) реакции необходимо понизить температуру.
Повышение давления вызовет стремление системы ликвидировать избыточное давление за счет образования меньшего количества газов, в результате скорость прямой реакции возрастет по сравнению со скоростью обратной и равновесие сместится в сторону преимущественного протекания прямой реакции. Для смещения равновесия в сторону прямой реакции концентрацию СО надо повышать, а СО2 выводить из системы.
Пример 4При 800С реакция протекает за 16 мин. За какое время закончится реакция а) при 1200С, б) при 600С, если γ=2.
Решение
В решении используем уравнение Аррениуса
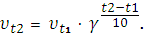
а) 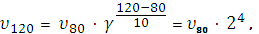
отсюда υ120/ υ80 = 24 = 16,
т. е. при повышении температуры с 800 до 1200С скорость реакции возросла в 16 раз, для проведения реакции потребуется 1 мин.
б)  ,
,
отсюда  60/
60/  80 = 1/4,
80 = 1/4,
то есть при понижении температуры от 800 до 600С скорость реакции уменьшится в 4 раза, для проведения реакции потребуется 64 мин.
Дата добавления: 2019-12-09; просмотров: 346;










