ФИЗИЧЕСКИЕ СВОЙСТВА.
АЛКАНОЛЫ (СПИРТЫ). КЛАССИФИКАЦИЯ
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на соответствующее количество гидроксильных групп – ОН. Спирты называют еще алкоголятами (от арабского ,,алкоголь” – спирт).
КЛАССИФИКАЦИЯ
Спирты классифицируют по количеству гидроксильных групп, которые содержатся в его молекуле, а также по характеру его углеродного атома (первичного, вторичного, третичного), с которым соединена гидроксильная группа. Количество гидроксильных групп в молекуле спирта называют его атомностью. По атомности спирты разделяют на одно-, двух-, трех- и многоатомные. Одноатомные спирты имеют одну гидроксильную группу, двухатомные – две, трехатомные – три гидроксильные группы и т.д. Спирты, которые имеют четыре и больше гидроксильных групп, называют многоатомными. Примером одноатомного спирта является этиловый спирт Н3С-СН2-ОН, двухатомного – этиленгликоль НО-СН2-СН2-ОН, трехатомного – глицерин СН2(ОН)-СН(ОН)-СН2-ОН, многоатомного – гексит СН2(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СН2-ОН.
В зависимости от того, с каким углеродным атомом – первичным, вторичным или третичным – соединена гидроксильная группа, различают первичные, вторичные и третичные спирты. Например, первичный бутиловый спирт Н3С – СН2 – СН2 – СН2 – ОН, вторичный бутиловый спирт Н3С – СН2 – СН(ОН) – СН3, третичный бутиловый спирт (Н3С)3С – ОН. Ознакомление с классом спиртов начнем с простейших – насыщенных (предельных) одноатомных спиртов, которые имеют общую формулу CnH2n+1 – OH.
ОДНОАТОМНЫЕ СПИРТЫ.
Одноатомные спирты образуют гомологический ряд, который можно легко записать, используя гомологический ряд насыщенных (предельных) углеводородов, заменяя в них один атом водорода на гидроксильную группу (табл.1).
НОМЕНКЛАТУРА.
Одноатомные спирты называют по исторической (тривиальной или эмпирической), рациональной и систематической (международной или ИЮПАК) номенклатурам (табл.1). По исторической номенклатуре название одноатомного спирта происходит от названия радикала, с которым соединена гидроксильная группа. Например, метиловый спирт, этиловый спирт, пропиловый спирт и т.д. По рациональной номенклатуре спирты рассматривают как замещенные самого простого из спиртов – метилового, который называют карбинолом. Например, метилкарбинол, этилкарбинол и т. д. По систематической номенклатуре название спирта образуют от названия соответствующего предельного углеводорода, прибавляя к нему суффикс – ол. Положение гидроксильной группы обозначают номером атома углерода, возле которого она расположена. Углеводородную цепь нумеруют так, чтобы атом углерода с гидроксильной группой имел наименьшее числовое значение. Например:
|
|


Некоторые спирты имеют еще эмпирические названия, которые связаны с историей открытия или получения этого спирта из того или другого природного продукта. Например, метиловый спирт часто называют древесным, поскольку его получают сухой перегонкой древесины, этиловый спирт называют винным, поскольку его впервые обнаружили в виноградном вине и длительное время получали перегонкой вина. Отсюда пошло и латинское название этого спирта – Spiritus Vini - ,,дух вина”.
1.4. ИЗОМЕРИЯ
Изомерия спиртов может быть обусловлена разветвлением углеводородной цепи ее молекулы, положением гидроксильной группы в этой цепи, а также конформацией. Первые два члена гомологического ряда спиртов (табл. 1) - метиловый Н3С-ОН и этиловый Н3С-СН2-ОН – изомеров не имеют. Пропиловый спирт существует в виде двух изомеров – первичного и вторичного (изо-)пропилового спирта. Легко заметить, что эти спирты отличаются один от другого положением гидроксильной группы в молекуле. У бутилового спирта четыре изомера (табл. 1) – первичный и вторичный

| Н3С – СН2 – СН2 – СН3 | Н3С – СН2 – СН3 | Н3С – СН3 | СН4 | Формула | Насыщенные (предельные) углеводороды | Гомологический ряд, номенклатура и физические свойства некоторых одноатомных спиртов. | Таблица 1 | ||
| 2-метил-пропан | Бутан | Пропан | Этан | Метан | Название по систематиче-ской номен-клатуре | |||||
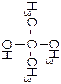
| 
| 
| Н3С–СН2–СН2–СН2–ОН | 
| Н3С–СН2–СН2–ОН | Н3С – СН2 - ОН | Н3С - ОН | Формула | Одноатомные спирты | |
| Третичный бутиловый | Изобутиловый | Вторичный бутиловый | Бутиловый | Изопропиловый | Пропиловый | Этиловый | Метиловый | Историческая | Номенклатура | |
| Триметилкарбинол | Изопропилкарбинол | Метилэтилкарбинол | Пропилкарбинол | Диметилкарбинол | Этилкар-бинол | Метилкарбинол | Карбинол | Рацио-нальная | ||
| 2-метил-пропанол-2 | метилпропа-нол-1 | Бутанол-2 | Бутанол-1 | Пропанол-2 | Пропанол-1 | Этанол | Метанол | Система-тическая | ||
| 82,8 | 107,3 | 99,5 | 117,1 | 82,3 | 97,2 | 78,3 | 64,7 | tкип.оС | ||
| 0,788 | 0,801 | 0,808 | 0,809 | 0,785 | 0,804 | 0,789 | 0,792 | Плотность
|
бутиловые, изобутиловый и третичный бутиловый спирты. Изомеры бутилового спирта отличаются между собой как строением углеродной цепи, так и положением гидроксильной группы в молекуле.
МЕТОДЫ ПОЛУЧЕНИЯ
Предельные одноатомные спирты можно получить следующими методами:
1. Окисление насыщенных углеводородов.
Алканы при каталитическом (например, солей марганца) окислении могут образовывать ряд кислородсодержащих соединений, в том числе и спирты.
 , где m < n.
, где m < n.
Этот метод имеет промышленное значение для получения высших жирных спиртов.
2. Гидролизом галогеналканов, который приводит к замещению атома галогена на гидроксильную группу.
 .
.
 3. Гидратацией этиленовых углеродов в присутствии таких катализаторов, как Н2SО4, H3PO4 и т.д. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответственно минеральную кислоту. Например:
3. Гидратацией этиленовых углеродов в присутствии таких катализаторов, как Н2SО4, H3PO4 и т.д. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответственно минеральную кислоту. Например: 
4. Восстановлением альдегидов, кетонов, карбоновых кислот и сложных эфиров водородом в присутствии катализаторов (Ni, Pt, Pd).
Альдегиды, карбоновые кислоты и сложные эфиры при этом присоединяют водород и образуют первичные спирты, а кетоны в аналогичных условиях – вторичные спирты.
Как восстановители этих веществ используют также комплексные гидраты металлов, например литийалюминийгидрид (LiAlH4).
|
|
|
|
|
|

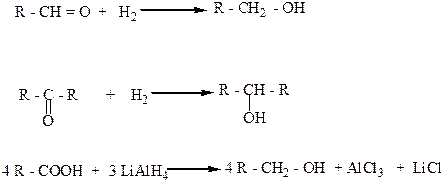
5. Взаимодействие альдегидов, кетонов, сложных эфиров с металлорганическими веществами, главным образом магнийорганическими (реактивами Гриньяра). При этом из муравьиного альдегида образуются первичные спирты, из других альдегидов – вторичные, а из кетонов и сложных эфиров – третичные спирты.
|
|
|
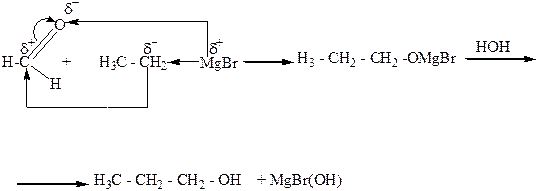

|
|
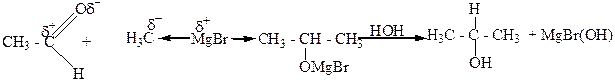
|

|
|
|

6.Щелочным или кислотным гидролизом сложных карбоновых кислот:


этилацетат уксусная кислота этанол
ФИЗИЧЕСКИЕ СВОЙСТВА.
Предельные одноатомные спирты от С1 до С10 в обычных условиях жидкости. Высшие спирты, начиная с С11 – твердые вещества. Все спирты легче воды. Их плотность меньше единицы. Низшие спирты, от С1 до С3, смешиваются с водой в любых соотношениях; спирты от С4 до С10 трудно растворяются в воде, а высшие спирты от в ней практически не растворяются. Запах низших спиртов алкогольный, начиная с С4 – неприятный. Высшие спирты запаха не имеют. Температура кипения спиртов повышается по мере увеличения их молекулярной массы (табл.1). Следует отметить, что температуры кипения спиртов значительно выше, чем температуры кипения соответствующих предельных углеводородов и их галогенпроизводных с таким же количеством углеродных атомов, как и в спирте. Например, этан кипит при -88,3оС, а бромистый этил С2Н5Br – при +38,0оС, а этиловый спирт С2Н5ОН - при +78,5оС, хотя молекулярная масса бромистого этила выше, чем этилового спирта. Такое повышение температуры кипения спиртов объясняется тем, что молекулы спирта, как и молекулы воды, хотя и в меньшей степени, являются ассоциированными и соединенными между собой водородными связями:


 Электроотрицательный атом кислорода, который имеет еще и свободные электронные пары, одной молекулы спирта притягивает атом водорода гидроксила другой молекулы спирта, на котором есть заряд δ+. Такое межмолекулярное взаимодействие приводит к ассоциации молекул спирта, что является причиной высокой температуры кипения этих веществ. Чем меньше алкильных групп окружает гидроксил в молекуле спирта, тем легче проявляются водородные связи и тем в большей мере осуществляется ассоциация молекул спирта, а отсюда, тем выше температура кипения спирта. Поэтому первичные спирты кипят при более высокой температуре, чем изомерные ему вторичные, а третичные спирты по этой же причине имеют ещё более низкую температуру кипения (табл.1). Таким образом, спирты с нормальным строением кипят при более высокой температуре, чем спирты с разветвлённой углеродной цепочкой.
Электроотрицательный атом кислорода, который имеет еще и свободные электронные пары, одной молекулы спирта притягивает атом водорода гидроксила другой молекулы спирта, на котором есть заряд δ+. Такое межмолекулярное взаимодействие приводит к ассоциации молекул спирта, что является причиной высокой температуры кипения этих веществ. Чем меньше алкильных групп окружает гидроксил в молекуле спирта, тем легче проявляются водородные связи и тем в большей мере осуществляется ассоциация молекул спирта, а отсюда, тем выше температура кипения спирта. Поэтому первичные спирты кипят при более высокой температуре, чем изомерные ему вторичные, а третичные спирты по этой же причине имеют ещё более низкую температуру кипения (табл.1). Таким образом, спирты с нормальным строением кипят при более высокой температуре, чем спирты с разветвлённой углеродной цепочкой.
 Энергия водородных связей намного меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет 456,36 кДж/моль. Во время кипения все водородные связи разрушаются.
Энергия водородных связей намного меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет 456,36 кДж/моль. Во время кипения все водородные связи разрушаются.
 Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный момент метилового спирта равняется 1,69 D. Валентный угол,
Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный момент метилового спирта равняется 1,69 D. Валентный угол, 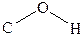 образованный связями атома кислорода в молекуле спирта, , составляет 110о25/.
образованный связями атома кислорода в молекуле спирта, , составляет 110о25/.
Дата добавления: 2022-05-27; просмотров: 40;










