Свойства обратимых и необратимых циклов
При исследовании необратимых циклов показано, что из-за потерь внешняя работа меньше внешней работы в обратимом процессе. Работа необратимого цикла также меньше работы обратимого цикла, т.к. работа расширения газа идёт не только на совершение внешней работы, но частично на преодоление потерь, связанных с необратимостью. На работу сжатия тоже тратится больше работы, т.к. часть этой работы идёт на преодоление потерь. Рассмотрим подробнее свойства обратимых и необратимых циклов.
Свойства обратимого цикла Карно
Для обратимого цикла Карно имеем
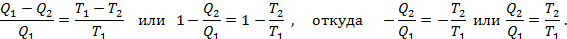
Перенеся оба члена в одну сторону, получим
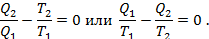
Учитывая знак Q2, можно записать
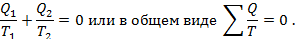
Отношение Q/T называется приведённой теплотой. Из данного уравнения следует, что алгебраическая сумма приведённых теплот в обратимом цикле Карно равна нулю.
Свойства произвольного обратимого цикла
Т.к. в произвольном цикле температуры, при которых подводится и отводится тепло, непостоянны, как в цикле Карно, то непосредственно перенести полученное выше выражение на произвольный обратимый цикл нельзя. Разобьём цикл адиабатами и изотермами на n элементарный циклов Карно (рис.6.7). Для каждого из них справедливо полученное выше условие.
Для первого элементарного цикла Карно будем иметь
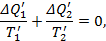 где ΔQ1’ – подведённая теплота в первом цикле, ΔQ2’ – отведённая теплота в первом цикле, а T1’ и T2’ – температуры источника и холодильника (в нашем случае n источников с температурами T1 и n холодильников с температурами T2). Аналогично для второго и всех последующих циклов
где ΔQ1’ – подведённая теплота в первом цикле, ΔQ2’ – отведённая теплота в первом цикле, а T1’ и T2’ – температуры источника и холодильника (в нашем случае n источников с температурами T1 и n холодильников с температурами T2). Аналогично для второго и всех последующих циклов
| 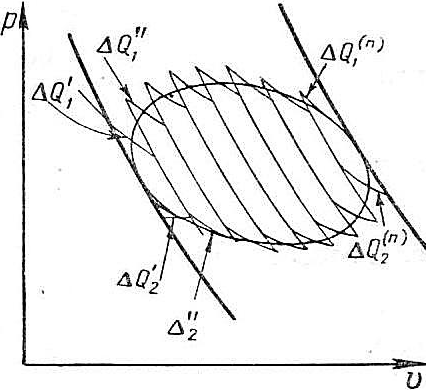 Рис. 6.7.
Рис. 6.7.
|

Складывая почленно эти равенства, получим
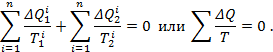
Свойства необратимого цикла Карно
Для необратимого цикла Карно должно выполняться неравенство
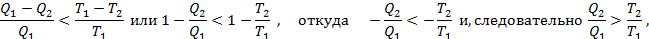
т.е.
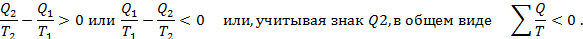
Таким образом, в необратимом цикле Карно алгебраическая сумма приведённых теплот меньше нуля.
Свойство произвольного необратимого цикла
Разбивая произвольный необратимый процесс на большое число необратимых циклов Карно и используя их основное свойство, выраженное приведённой выше формулой, получим

Следовательно, в произвольных необратимых циклах алгебраическая сумма приведённых теплот оказывается меньше нуля.
Во всех полученных уравнениях Q1 – теплота, полученная газом от источника, Q2 – теплота, отданная газом холодильнику, T1 и T1 – температуры источника и холодильника.
Обобщая проведённый выше анализ, общее свойство обратимых и необратимых циклов Карно можно выразить уравнением
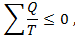
а общее свойство произвольных обратимых и необратимых циклов уравнением
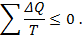
Знак равенства относится к обратимым циклам, а знак неравенства – к необратимым.
Энтропия
Выражение 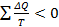 показывает, что для произвольного обратимого цикла сумма приведённых теплот не зависит от процесса, а лишь от начального и конечного состояний газа. Но переменные величины, изменение которых не зависит от процесса, а только от начального и конечного состояний, называются функциями состояния. Выражение показывает, что для произвольного обратимого цикла сумма приведённых теплот не зависит от процесса, а лишь от начального и конечного состояний газа. Но переменные величины, изменение которых не зависит от процесса, а только от начального и конечного состояний, называются функциями состояния. Выражение 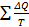 можно рассматривать как изменение некоторой функции состояния S, называемой энтропией. Изменение её (S2-S1) при переходе газа из начального состояния в конечное (рис.6.8) определяется как можно рассматривать как изменение некоторой функции состояния S, называемой энтропией. Изменение её (S2-S1) при переходе газа из начального состояния в конечное (рис.6.8) определяется как
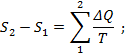
| 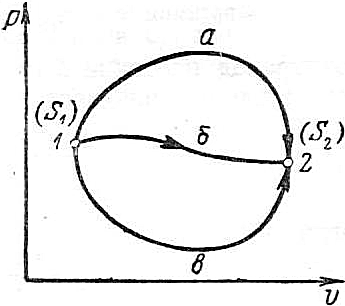 Рис. 6.8.
Рис. 6.8.
|
Это изменение не зависит от характера процесса, т.е. ΔSа=ΔSб=ΔSв=S2-S1, где S1 – энтропия начального состояния, S2 – энтропия конечного состояния газа. Данное уравнение характеризует изменение энтропии в обратимых процессах. Т.е. энтропия представляет собой некоторую однозначную функцию состояния тела, изменение которой не зависит от характера процесса, а определяется только начальным и конечным состояниями тела.
Если рабочее тело в результате обратимого цикла возвращается в первоначальное состояние, то общее изменение энтропии тела в циклах равно нулю, т.е.
ΔSцикла=0.
Размерность энтропии – Дж/кг·град.
Изменение энтропии в необратимых процессах
Допустим, тело в необратимом процессе 1-а-2 переходит из состояния 1 в состояние 2 (рис.6.9), а возвращается в первоначальное состояние обратимым процессом 2-б-1. Энтропия тела в состоянии 1 будет S1, а в состоянии 2 – S2. Т.к. в данном цикле имеется один необратимый процесс, то цикл необратимый. Основное свойство необратимого цикла выражается уравнением
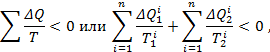 но переход из точки 2 в точку 1 совершается обратимым процессом, следовательно
но переход из точки 2 в точку 1 совершается обратимым процессом, следовательно
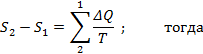
| 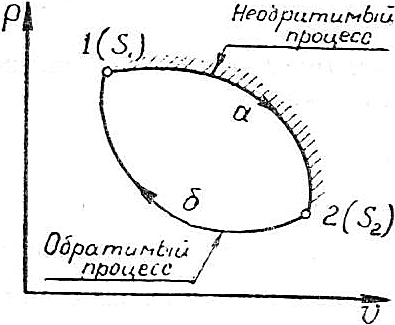 Рис. 6.9.
Рис. 6.9.
|
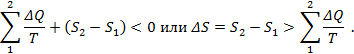
Поскольку изменение энтропии в необратимом процессе а равно изменению энтропии в обратимом процессе б (т.к. у процессов одинаковое начальное и конечное состояния), то из уравнения следует
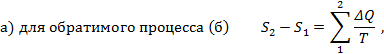

Следовательно, разность
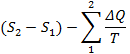
служит мерой необратимости процесса, возрастающей с увеличением явлений необратимости. Т.е. изменение энтропии, являющейся мерой необратимости процессов, характеризует качественное состояние энергии с точки зрения превращения её в работу. Так, рост энтропии говорит об уменьшении работоспособности тела, т.к. растут потери на преодоление возрастающих явлений необратимости.
Изменение энтропии в конечной изолированной системе
Изолированная система это термодинамическая система, состоящая их отдельных тел (источников теплоты и холодильников), не имеющая теплообмена с окружающей средой. Изолированная система является адиабатной – Q=0. Общее изменение энтропии системы определяется алгебраической суммой изменений энтропии её элементов ΔSсист=ΔS1+ΔS2+…+ΔSn. Если в изолированной системе протекают только обратимые процессы, то при Q=0 изменение энтропии не происходит, S2-S1=0, т.е. S1=S2=const – энтропия системы не изменяется. Если в изолированной системе протекают необратимые процессы, то при Q=0 изменение энтропии примет вид S2-S1>0, т.е. S1>S2 – энтропия системы возрастает.
7. Система координат S – T
При исследовании процессов до сих пор использовалась система координат v–p. В этой системе наглядно выражались работы расширения, сжатия, а также работа цикла как соответствующие площади. Однако при этом не затрагивалась другая, не менее важная сторона преобразования теплоты в работу – экономичность двигателя. Степень совершенства превращения теплоты в работу охарактеризована термическим КПД цикла 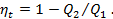 Можно построить систему координат, в которой теплота выражается площадью. Это система координат S–T. Предположим, что кривая AB (рис.6.12) представляет некий термодинамический процесс. Рассмотрим элементарную (заштрихованную) площадку под кривой, площадь которой определяется произведением TΔS. Т.к. TΔS=Q, то, суммируя все площади под кривой, получим Q=ΣTΔS, причём всё тепло, Можно построить систему координат, в которой теплота выражается площадью. Это система координат S–T. Предположим, что кривая AB (рис.6.12) представляет некий термодинамический процесс. Рассмотрим элементарную (заштрихованную) площадку под кривой, площадь которой определяется произведением TΔS. Т.к. TΔS=Q, то, суммируя все площади под кривой, получим Q=ΣTΔS, причём всё тепло,
| 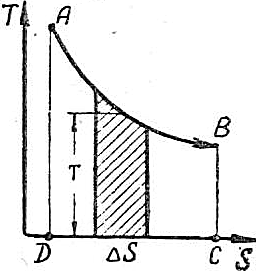 Рис. 6.12.
Рис. 6.12.
|
участвующее в процессе, будет выражаться всей площадью под данной кривой.
Т.к. T всегда больше нуля, знак ΔS будет совпадать со знаком ΔQ. При отводе тепла (-ΔQ) изменение энтропии газа отрицательно, т.е. ΔS<0 или S2<S1. Поэтому направление процесса с отводом тепла будет справа налево в диаграмме S–T (рис.6.13). При подводе тепла (+ΔQ) изменение энтропии положительно, S2>S1. Поэтому направление процесса с подводом тепла в диаграмме S – T будет слева направо.
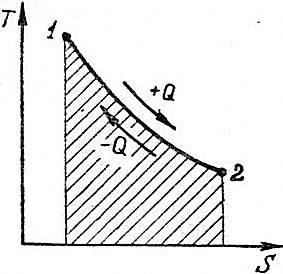 Рис. 6.13.
Рис. 6.13.
| 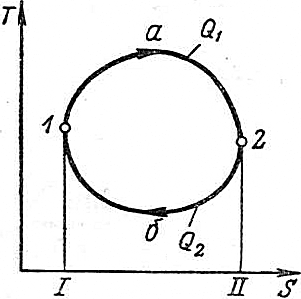 Рис. 6.14.
Рис. 6.14.
|
Изобразим в координатах S–T цикл – кривая 1-а-2-б-1 (рис. 6.14.). Площадь I-1-а-2-II-I численно равна количеству подведённого тепла, а площадь I-1-б-2-II-I – количество отведённого тепла. В этом случае термический КПД цикла определяется следующим образом:
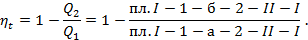
Заметим, что площадь, ограниченная контуром цикла, т.е. площадь 1-а-2-б-1, определяет тепло, эквивалентное работе цикла и равное Q1-Q2=Lц. Система координат S–T широко применяется при расчётах двигателей. По ней можно определить параметры газа в любых точках кривой, изображающей цикл, термический КПД теоретического цикла, внешние теплоты и работу цикла.
Определение изменения энтропии в обратимых процессах для идеального газа
Энтропия как функция состояния может быть выражена через любые два параметра газа: p, v; p, T; v, T. При выводе соотношения для изменения энтропии S2-S1 идеального газа воспользуемся двумя уравнениями: 1) уравнение первого закона термодинамики, написанного в форме ΔQ=cvΔT+pΔv и 2) уравнением состояния идеального газа pv=RT.
Вывод формулы для ΔS=S2-S1 при переменных v и T
По определению
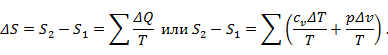
Т.к. p/T=R/v, то
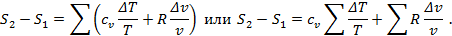
Учитывая, что
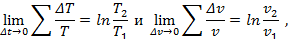
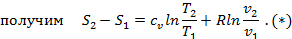
Вывод формулы для ΔS=S2-S1 при переменных p и v
Из уравнения состояния для начального и конечного состояний идеального газа в процессе имеем p2v2=RT2 и p1v1=RT1. Разделив почленно первое выражение на второе, будем иметь
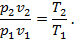
Подставляя из этого выражения T2/T1 в полученную выше формулу (со звёздочкой), получим
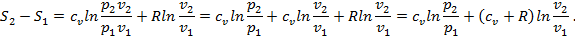
Но cv+R=cp, поэтому
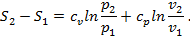
Вывод формулы для ΔS=S2-S1 при переменных p и T
Подставим в полученную выше формулу со звёздочкой
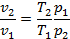
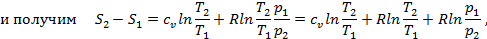
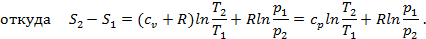
Полученные формулы выведены для газа, параметры p1, v1, T1 и p2, v2, T2 являются его параметрами. Т.к. энтропия есть функция состояния, формулы справедливы для любых процессов. В зависимости от того, подводится или отводится внешнее тепло, изменение энтропии газа больше или меньше нуля.
Дата добавления: 2017-11-21; просмотров: 1824;










